آزمایشگاه تجزیه 2
مجموعه گزارشکارهای تجزیه۲ بانمودار و محاسبات وپاسخ سوالات
لینک دانلود:
پسوردفایل ها:
این مطلب در تاریخ: یک شنبه 1 دی 1392 ساعت: 1:52 منتشر شده است
برچسب ها : آزمایشگاه تجزیه 2,
 اميرحسين - واقعا دستتان درد نكند - 1392/2/17
اميرحسين - واقعا دستتان درد نكند - 1392/2/17
 قنبرآبادی - سلام.ممنون فقط لطفا اگه برنامه مقاله را هم داریدلطف کنید.مرسی - 1392/1/9
قنبرآبادی - سلام.ممنون فقط لطفا اگه برنامه مقاله را هم داریدلطف کنید.مرسی - 1392/1/9
 لولو - http://loxblog.ir/images/smilies/smile%20(10).gifhttp://loxb log.ir/images/smilies/smilhthttp://loxblog.ir/images/smiliht tp://loxblog.ir/images/smilieshttp://loxblog.ir/images/smili es/smile%20(26).gif/smile%20(30).gifes/smile%20(3)http://loh ttp://loxblog.ir/images/smilies/smile%20(27).gifxblog.ir/ima ges/smilies/smile%20(14).gif.giftp://loxblog.ir/images/smili eshttp://loxblog.ir/imhttp://loxblog.ir/images/smilies/smile %20(30).gifages/smilies/smile%20(12).gif/smile%20(5).gife%20 (10).gifhttp://loxblog.ir/images/smilies/smile%20(29).gif - 1392/1/5
لولو - http://loxblog.ir/images/smilies/smile%20(10).gifhttp://loxb log.ir/images/smilies/smilhthttp://loxblog.ir/images/smiliht tp://loxblog.ir/images/smilieshttp://loxblog.ir/images/smili es/smile%20(26).gif/smile%20(30).gifes/smile%20(3)http://loh ttp://loxblog.ir/images/smilies/smile%20(27).gifxblog.ir/ima ges/smilies/smile%20(14).gif.giftp://loxblog.ir/images/smili eshttp://loxblog.ir/imhttp://loxblog.ir/images/smilies/smile %20(30).gifages/smilies/smile%20(12).gif/smile%20(5).gife%20 (10).gifhttp://loxblog.ir/images/smilies/smile%20(29).gif - 1392/1/5
 سارا - سلام این ازمایشهای جالب را از کجا اوردین
سارا - سلام این ازمایشهای جالب را از کجا اوردین فلاحتکار - سلام
فلاحتکار - سلام  SARA - مرسی مطلب خوب ومفیدی بود... - 1391/10/19
SARA - مرسی مطلب خوب ومفیدی بود... - 1391/10/19
 7887 - لطفا آزمایش های جالب برای دوم راهنمایی باشند ولی نه آزمایش های گتاب - 1391/10/13
7887 - لطفا آزمایش های جالب برای دوم راهنمایی باشند ولی نه آزمایش های گتاب - 1391/10/13
مجموعه گزارشکارهای تجزیه۲ بانمودار و محاسبات وپاسخ سوالات
لینک دانلود:
پسوردفایل ها:
نويسنده : کامران مومن زاده
گزارشکارهای کامل آزمایشگاه تجزیه۱به همراه محاسبات واستوکیومتری
تيتراسيون اسيد و باز
تيتراسيون هاي رسوبي (موهر)
تيتراسيون هاي اکسايش و کاهش
اندازه گيري يون کلسيم و منيزيم و سختي آب
PH متري
هدايت سنجي
پتانسيومتري
لینک دانلود:
http://s1.picofile.com/file/7507876769/%D8%A2%D8%B2_%D8%AA%D8%AC%D8%B2%DB%8C%D9%87_1.rar.html
پسورد تمامی فایل ها:
مجموعه گزارشکارهای آزمایشگاه شیمی فیزیک 2 کامل به همراه محاسباتوپاسخ سوالات ونمودار
جذب گازها و دفع آنها
تعيين درجه واکنش
تعيين درجه واکنش
تعيين ثابت هيدروليز هيدروکلريد آنالين به روش pHm
تعيين ثابت تفکيک اسيدي اسيد استيک به روش هدايت سنجي
اندازه گيري ويسکوزيته
تععين حاصلضرب حلاليت
حجم مولي جزئي
کشش سطحي
سينيتيک واکنشهاي يوني در محلول
ضريب شکست
لینک دانلود:
پسوردفایل:
مجموعه گزارشکارهای آزمایشگاه شیمی فیزیک 1 کامل به همراه محاسباتوپاسخ سوالات
لینک دانلودمستقیم
پسوردفایل:
کارشناس آزمایشگاه:
نويسنده : کامران مومن زاده
استاد : دکتر رحیمی
این آزمایشگاه مربوط به رشته های فنی مهندسی و علوم پایه است.
در این آزمایشگاه آزمایشهای زیر انجام می گیرد
آزمایشگاه شیمی تجزیه 1
جلسه 1: محلول سازی
جلسه 2: آزمایش اسیدیمتری
جلسه 3: آزمایش آلکالیمتری
جلسه 8: آزمایش اندازه گیری نیکل توسط دی متیل گلی اکسایم (تجزیه وزنی)
جلسه 9: آزمایش تیتراسیون کمپلکسومتری برگشتی اندازه گیری نیکل
جهت دانلود فایل کامل دستور کار روی عنوان آزمایشگاه کلیک نمایید.
نام و نام خانوادگی: کامران مومن زاده
استاد : دکتر قربانی
این آزمایشگاه مربوط به رشته های فنی مهندسی و علوم پایه است.
در این آزمایشگاه آزمایشهای زیر انجام می گیرد:
آزمایشگاه شیمی آلی 1
جلسه 1: اندازه گیری نقطه ذوب
جلسه 2: اندازه گیری نقطه جوش
جلسه 3: کروماتوگرافی
جلسه 4: تبلور مجدد
جلسه 5: استخراج
جلسه 6: آنالیز کیفی ترکیبات آلی ( شناسایی نیتروژن و هالوژن ها)
جلسه 7: تقطیر
جهت دانلود فایل کامل دستور کار روی عنوان آزمایشگاه کلیک نمایید.
تیوسولفات سدیم نمک اسید تیو سولفوریک می باشد که این اسید بر خلاف نمک هایش بسیار ناپایدار است. اگر به محلول تیوسولفات سدیم محلول یک اسید قوی مثل اسید کلریدریک افزوده شود پس از اندک مدتی گوگرد رسوب نموده و محلول شدیدا بوی انیدرید سولفورو می دهد.
تیوسولفات سدیم به آسانی کلر را احیا می نماید.
Na2SO3 + H2O + Cl2 → Na2SO4 +۲HCl + S
اگر مقدار کلر زیاد باشد عدد اکسایش گوگرد از ۲- به ۶+ می رسد.
Na2SO3 + 5H2O + 4Cl2 → ۲Na2HSO4 + 8HCl
برای مطالعه ادامه گزارش کار و روش تهیه تیو سولفات سدیم به ادامه مطلب بروید.
در عکاسی سدیم تیوسولفات به عنوان داروی ثبوت مصرف می گردد. زیرا تیوسولفات بر هالوژن های نقره اثر کرده و به آسانی انها را حل می نماید ولی بر خود نقره بی اثر است.
AgCl +2Na2SO3 → Na3[Ag(S2O3)2] + NaCl
در شیمی تجزیه واکنش بین تیوسولفات و ید اساس سنجش های یدومتری می باشد.
برای تهیه نمک تیوسولفات می توان از سولفیت سدیم و گل گوگرد استفاده نمود. اگر سولفیت سدیم در دسترس نباشد می توان ان را از اثر گاز SO2 بر کربنات سدیم بدست اورد. گاز SO2 از اثر اسید سولفوریک غلیظ بر پودر مس تهیه می گردد.
دستگاهی مطابق شکل زیر سوار کنید و نمک سولفیت سدیم را تهیه نمایید. سرعت خروج گاز SO2 را می توان توسط شعله و میزان اسید سولفوریک غلیظ کنترول نمود.
مواد مورد نیاز:
سولفیت سدیم ، گوگرد ، آب مقطر ، بشر ۳۰۰ میلی لیتری ، ترازو ، هیتر ، قیف ، کاغذ صافی ، ارلن
روش تهیه :
ابتدا ۶ گرم سولفیت سدیم را همراه با ۳۰ میلی لیتر آب مقطر در یک بشر ۳۰۰ میلی لیتری وارد نموده و تا نقطه جوش حرارت دهید تا حل گردد. ۲ گرم گوگرد اضافه نموده و محلول تعلیقی حاصل را بجوشانید تا تقریبا تمام گوگرد وارد واکنش شود. محصول را تا داغ است صاف کنید. محلول زیر صافی را تبخیر نموده تا تبلور شروع شود. سپس در حمام یخ سرد نموده و توسط پمپ خلا صاف نمایید. ماده بدست امده را در یک اون در دمای ۴۰ تا ۵۰ درجه سانتیگراد خشک نمایید.
تعیین آب تبلور محصول بدست آمده :
۲٫۴۸ گرم از نمک بدست امده را در اب مقطر حل نموده و به حجم ۱۰۰ میلی لیتر برسانید و انرا توسط محلول استاندارد تیتر نمایید. برای تهیه محلول استاندارد ۱٫۲۷ گرم ید و ۱ گرم یدور پتاسیم را همراه با اب مقطر در بالن ژوژه ۱۰۰ میلی لیتری وارد نموده و با اضافه نمودن اب مقطر بعد از انحلال کامل ان را به حجم برسانید. ۱۰ میلی لیتر از محلول نمک بدست امده را در مجاورت چسب نشاسته با محلول استاندارد تیتر نمایید.
برای دانلود گزارش کار آزمایشگاهی روش تهیه و استاندارد کردن سدیم تیو سولفات ۰٫۱ مولار به ادامه مطلب بروید.
نام فایل : Preparation and standardization of 0.1 M Na2S2O3
نوع فایل : pdf
حجم فایل : ۲۵۷ کیلوبایت
رمز عبور : ندارد
لینک دانلود : دانلود
استاد : دکتر رحیمی
نويسنده : کامران مومن زاده
نام آزمایش: تعیین میزان آهن آرد به روش اسپکتروفتومتری
هدف آزمایش:
دامنه کاربرد: این روش برای اندازه گیری آهن درغلات و آردهای حاصل از آنها – آردهای غنی شده و آماده شده برای پخت و فرآوردههای آنها کاربرد دارد.
وسائل و مواد آزمایش:
خاکستر آرد- اسید کلریدریک – بن ماری – آزیتاتور- کاغذ صافی- بالن ژوژه- محلول استاندارد آهن – محلول هیروکسیل آمین – محلول تامپون استات
محلول ارتوفنانترولین
تئوری آزمایش:
عنوان: اسپکتروفتومتری
هدف: آشنایی با دستگاه اسپکتروفتومتر
تئوری: اسپکتروفتومتر ناحیه مریی Spectrophotometer
تعریف اسپکتروفتومتری:
اسپکتروفتومتری یک روش تجزیه دستگاهی است که در آن تابش الکترومغناطیسی در ناحیه مرئی و ماورا بنفش جذب ماده میشود، و از روی شدت جذب مقدار ماده تعیین میشود.
نام آزمایش
تیتراسیون آهن (II) با سریم (IV)
عنوان
تیتراسیون آهن (II) با سریم (IV)
هدف
اندازه گیری درصد آهن در یک ترکیب از طریق تیتراسیون پتانسیومتری آهن (II ) با محلول استاندارد سریک آمونیوم نیترات
مواد لازم
تیتر شونده: آهن (II ) با غلظت 0.1 مولار
تیتر کننده: محلول 0.1 مولار سریک آمونیوم نیترات
وسايل لازم
مگنت ، بشر ، بالن ژوژه ، پیپت حبابدار ، بورت،پایه بورت،همزن مغناطیسی،الکترود شناساگر پلاتین،الکترود مرجع
تئوری :
به معناي سنجش و اندازه گيري پتانسيل است. در شاخه اي از شيمي به نام الكتروشيمي ، بحث از پيل الكتروشيميايي است. پيل الكتروشيميايي دستگاهي است كه انرژي واكنش شيميايي را كه در شرايط معمولي اغلب به صورت انرژي گرمايي آزاد مي شود، به انرژي الكتريكي قابل استفاده تبديل مي نمايد و مانند سدهاي هيدروالكتريك، مانع از به هدر رفتن انرژي مي شود. دو الكترود و يك پل نمكي ، تشكيل يك پيل را مي دهند. درواقع دو الكترود به دليل رقابت براي تبادل الكترون، تمايل متفاوت براي گرفتن الكترون دارند و اين تفاوت گرفتن الكترون، در شرايط مناسب سبب انتقال الكتريسيته مي شود. اين جريان الكتريسيته داراي يك ولتاژ يا پتانسيل خاص مي باشد كه با دستگاه ولت سنج قابل اندازه گيري است.
نويسنده : کامران مومن زاده
تئوری آزمایش:
پیوندهای شیمیایی اسید سیتریک
اسید استیک یا جوهر انگور جز اسیدهای کربوکسیلیک است و در نامگذاری آیوپاک به اسید اتانوئیک معروف است.
نگاه کلی اسید استیک جز اسیدهای کربوکسیلیک میباشد و در نامگذاری آیوپاک به اسید اتانوئیک معروف است. این اسید دارای فرمول شیمیایی میباشد و در قسمت چشایی طعم ترشی ، شبیه طعم سرکه میدهد.
باکتریهای مخمر سرکه به دلیل تمایل به تولید اسید استیک به این نام معروف شدهاند. این باکتریها در مواد غذایی ، آب و خاک یافت میشوند. اسید استیک بطور طبیعی از میوهها و برخی مواد غذایی فاسد شده از فرایند تخمیر تولید میشوند و از قدیمیترین ترکیبات شیمیایی شناخته شده توسط انسان میباشد. تاریخچه سرکه (اسید استیک رقیق) از دوران باستان برای انسان شناخته شده بود. احتمالاً انسانها در دوران باستان هنگام تهیه شراب از فرایند تخمیر به وجود سرکه پی برده بودند. فیلسوف یونانی تئوفاراستوس در سه قرن پیش از میلاد چگونگی واکنش سرکه با فلزات و تولید رنگدانه برای استفاده در نقاشی از کربنات سرب و زاجهای سبز ایجاد شده از نمکهای مس و استات مس را توضیح دادهاست. رومیان باستان با نگهداری شراب ترش در قدحهای سربی ، شراب بسیار شیرینی به نام Sapa تولید میکردند که طعم شیرین آن ناشی از استات سرب بودهاست که امروزه دانشمندان مرگ زودرس بسیاری از اشراف روم را به مسمومیت ناشی از این ماده نسبت دادهاند. شیمیدانهای عصر رنسانس اسید استیک گلاسیال (منجمد) را از تقطیر خشک استاتهای فلزی تهیه میکردند. در سال ۱۸۴۷ هرمن کولب شیمیدان آلمانی برای اولین بار اسید استیک را از مواد معدنی سنتز کرد. خواص اسید استیک خالص، مایعی بیرنگ با بویی تیز، مایعی خورنده و قابل اشتعال میباشد. این اسید در ۱۶٫۶ درجه سانتیگراد منجمد میشود. به این دلیل و همچنین ظاهر یخ مانند آن به نام اسید استیک گلاسیال معروف است. اسید استیک در محلولهای آبی میتواند تفکیک شده و یون استات تولید کند. PH آن برابر با ۴٫۸ میباشد، یعنی در PH=۴٫۸ نیمی از مولکولهای اسید استیک در محلول آبی به صورت یون استات هستند. اسید استیک در حالت بخار شامل دیمرهایی از دو مولکول اسید استیک میباشد که با پیوند هیدروژنی با یکدیگر ارتباط دارند.
عنوان : ازمایش اندازه گیری انرژی اکتیواسیون
هدف : اندازه گیری انرژی اکتیواسیون
تئوري آزمايش :
انرژي اكتيواسيون يكي از پارامترهاي در انجام واكنش هاي شيميايي است.
اثر دما بر ثابت سرعت واكنش به صورت زير خواهد بود :
اگر از طرفين رابطة فوق Ln بگيريم ، رابطه به صورت زير ساده مي شود
در دو دماي مختلف مقدار K به صورت زير خواهد بود :
از تفاضل دو رابطة بالا داريم
موضوع آزمايش: اندازه گيري انرژي اكتيواسيون
شرح آزمايش :
ابتدا محلول استات اتيل و محلول سود بسازيد.
از هر يك از اين محلول ها برداشته و به حجم برسانيد .
هدايت هر يك از اين محلول ها را به وسيلة كنداكتومتر اندازه بگيريد . (محلول سود را و محلول استات سديم را در نظر مي گيريم )
سپس از هر يك از اين محلول ها را برداشته و با هم مخلوط مي كنيم ، ميزان هدايت را در زمان هاي مختلف يادداشت مي كنيم .
اين آزمايش را در دو دماي انجام مي دهيم .
نتايج و محاسبات انجام شده :
1 7 6.74 -44.58
2 14 6.09 -10.86
3 21 5.56 -7.04
4 28 5.29 -6.05
5 35 5.03 -5.36
6 42 4.78 -4.85
1 7 8.69 -6.08
2 14 7.32 -3.89
3 21 6.69 -3.41
4 28 6.27 -3.17
5 35 5.71 -2.92
6 42 5.61 -2.88
این متن ناقص است برای مشاهده متن کامل آن را دانلود نمایید.
در صورت خراب بودن لینک دانلود " در قسمت نظر دهید " به ما اطلاع دهید تا مشکل را رفع کنیم
حجم فایل : 50 کیلو بایت | فرمت فایل : Docx | زبان : فارسی
دانلود مستقیم | پسورد فایل : kimiagari.ir
استاد :سحر ملکي
نويسنده : کامران مومن زاده
تبلور مجدد
تبلور مجدد یکی از بهترین روش های خالص سازی برای خالص کردن یک جامد است.در این روش اختلاف در حلالیت سبب جدا شدن اجسام از یک دیگر و یا سبب جدا شدن ناخالصی از یک جسم میشود.در تبلور مجدد مولکول ها به تدریج از محلول جدا شده و در ردیف های منظمی به یکدیگر متصل می گردند که به عنوان شبکه شناخته می شوند. در این روش ساختمان بلورین جسم جامد را با انحلال در حلال مناسب بطور کامل از بین می برند و سپس اجازه می دهند تا بلورهای جسم به صورت یک شبکه بلوری مجددا تشکیل شوند.نا خالصی ها معمولا در محلول باقی می مانند.
تبلور مجدد شامل چندین مرحله می باشد:
۱)انتخاب حلال مناسب
۲)انحلال جسم مورد تخلیص در نقطه جوش یا نزدیک آن
۳)صاف کردن محلول داغ برای جدا نمودن ناخالصی های نامحلول
۴)تبلور از محلولی که در حال سرد شدن است
۵)جدا کردن بلورها از محلولی که در آن شناور هستند
۶)شستشوی بلورها برای خارج کردن محلولی که به آنها آغشته است
۷)خشک کردن بلورها
استاد :سحر ملکي
نويسنده : کامران مومن زاده
اندازه گیری نقطه جوش
تعریف نقطه جوش:نقطه جوش دمایی است که در آن دما, فشار بخار جسم مایع با فشار اتمسفر برابر می شود.
نقطه جوش به عوامل زیر بستگی دارد:
۱_ فشار: بین نقطه جوش وفشار ارتباط مستقیم وجود دارد . اگر به تعریف نقطه جوش دقت شود فشار سیستم بالا رود نقطه جوش نیز بالا می رود و بالعکس.
تاثیر فشار بر نقطه جوش:
نقطه جوش یک مایع با تغییر فشار خارجی تغییر میکند. نقطه جوش نرمال یک مایع ، دمایی است که در آن فشار بخار مایع برابر با یک اتمسفر باشد . نقطه جوش داده شده در کتابهای مرجع ، نقاط جوش نرمال میباشند . نقطه جوش یک مایع را میتوان از منحنی فشار بخار آن بدست آورد و آن دمایی است که در آن فشار بخار مایع با فشار وارد بر سطح آن برابری میکند.
نوسانات فشار جو در یک موقعیت جغرافیایی ، نقطه جوش آب را حداکثر تا Cْ ۲ تغییر میدهد . ولی تغییر محل ممکن است باعث تغییرات بیشتر شود ، متوسط فشاری که هواسنج در سطح دریا نشان میدهد یک اتمسفر ، ولی در ارتفاعات بالاتر کمتر از این مقدار است. مثلا در ارتفاع ۵۰۰۰ پایی از سطح دریا متوسط فشاری که فشارسنج نشان میدهد atm 0.836 است و نقطه جوش آب در این فشار Cْ ۹۵٫۱ میباشد.

بنزوئیک اسید، (C7H6O2 (C6H5COOH، یک ترکیب بلوری بی رنگ (سفید دیده میشود) است. بنزوئیک اسید سادهترین کربوکسیلیک اسید آروماتیک نیز میباشد. این ماده یک اسید ضعیف محسوب میشود. از نمکهای آن به عنوان نگهدارندههای غذایی استفاده میشود، همچنین در ساخت بسیاری از ترکیبات آلی دیگر از بنزوئیک اسید استفاده میشود.
تاریخچه
بنزوئیک اسید در قرن شانزدهم میلادی کشف شد. اولین بار شخصی به نام Nostradamus از تقطیر خشک مادهای سنتی به نام gum benzoin بدست آورد. در سال ۱۸۷۵ شخصی به نام Salkowski نیز پی به خواص ضد قارچ بنزوئیک اسید برد.
عنوان آزمایش: تهیه اتیلن
(برای تهیه ی اتیلن روش کارهای مختلفی را می توان در کتابهای شیمی و اینترنت پیدا کرد.اما با وجود یکسان بودن اصل روش،گاهاً دستور کار چندان ساده و ملموس نیست.در این مطلب سعی می کنم ساده ترین روش تهیه اتیلن را که در هر آزمایشگاه شیمی و با ساده ترین امکانات قابل انجام است،بنویسم.)
هدف: تهیه ی اتیلن به روش آزمایشگاهی از اتانول و شناسایی آن با محلول پتاسیم پرمنگنات
مقدمه:
اتیلن ساده ترین آلکن با فرمول C2H4 است.که گازی است بی رنگ و بسیار آتش گیر.
برای تهیه اتیلن روش های مختلفی وجود دارد که از جمله می توان کراکینگ گرمایی اتان(1) و آبگیری از الکل(اتانول) (2)را نام برد.که روش اول صنعتی و روش دوم بیشتر جنبه ی آزمایشگاهی دارد.
(1) CH3-CH3 => CH2=CH2 + H2
(2) CH3-CH2-OH => CH2=CH2 + H2O
اتیلن ( و سایر آلکن ها) با پتاسیم پرمنگنات اکسید می شوند و به این ترتیب رنگ ارغوانی آن را تغییر می دهند.همچنین با آب برم نیز واکنش داده و رنگ قرمز قهوه ای آن را از بین می برند.(روش های شناسایی آلکن ها)
(C2H4 + 2KMnO4+4H2O= 3 C2H4(OH)2 + 2KOH + 2MnO2(s
MnO2 منگنز دی اکسید (قهوه ای رنگ)
KMnO4 پتاسیم پرمنگنات (ارغوانی)
پس تغییر رنگ در طی شناسایی از ارغوانی به قهوه ای خواهد بود.
در صورت استفاده از آب برم تغییر رنگ از قهوه ای یا زرد آب برم به بی رنگ خواهد بود.
C2H4+Br2= C2H4Br2
Br2: برم( قهوه ای یا زرد رنگ)
C2H4Br2 : دی برمو اتیلن (بی رنگ)
در انتها می توان گاز خروجی از لوله ازمایش را با احتیاط آتش زد،که در این صورت گاز اتیلن شعله ور می شود.
از اتیلن در صنعت برای تهیه پلاستیک پلی اتیلن بسیار استفاده می شود.همچنین اتیلن نوعی هورمون گیاهی است که در کشاورزی برای رسیدن میوه هایی که بصورت نارس چیده می شوند(مثل موز) استفاده می شود.
روش کار:
یک تکه پنبه کوچک را به کمک همزن شیشه ای یا یک پیپت در ته یک لوله آزمایش بزرگ قرار می دهیم.چند سی سی اتانول را توسط پیپت روی پنبه ای که ته لوله آزمایش گذاشته ایم،میریزیم،به طوری که کاملاً آغشته به الکل شود.(این آغشته شدن به الکل باید در حدی باشد که موقع افقی کردن لوله آزمایش الکل از پنبه نریزد.) سپس لوله آزمایش را به صورت افقی به میله و پایه ی فلزی وصل می کنیم.به کمک اسپاتول مقداری پودر آلومینیوم اکسید(آلومین) را در وسط لوله آزمایش قرار می دهیم.در لوله آزمایش را با یک درپوش سوراخ دار بسته و لوله ی شیشه ای خمیده ای را به آن وصل می کنیم.(مطابق شکل).
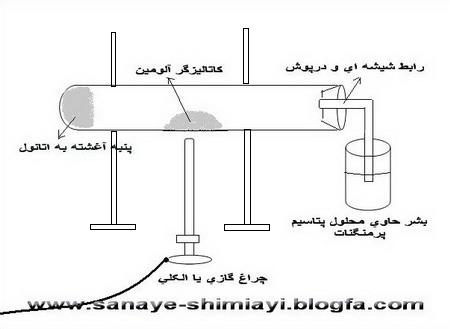
در یک بشر کوچک 50 سی سی تا نصف بشر محلول رقیق پتاسیم پرمنگنات( حدود 0.3% ) می ریزیم.و آن را زیر لوله رابط متصل به لوله آزمایش قرار می دهیم.حرارت را(در زیر قسمتی که آلومین قرار داده ایم) آغاز می کنیم.(گاهی نیز شعله را به سمت ته لوله آزمایش(جایی که پنبه را قرار داده ایم می بریم).اتانول در اثر حرارت و به کمک کاتالیزگر،آب زدایی شده و اتیلن تولید می کند.خروج گاز از لوله ی آزمایش با ایجاد حباب در محلول داخل بشر ثابت می شود.بخشی از این گاز بخار آب است و بخشی از آن گاز اتیلن.
با ورود اتیلن به داخل محلول پتاسیم پرمنگنات رنگ آن قهوه ای یا بی رنگ می شود.( بسته به اینکه محیط اسیدی باشد یا نه).
درست به همین روش می توان به جای پتاسیم پرمنگنات از آب برم نیز برای شناسایی اتیلن استفاده کرد.(بهتر است به جای برم از همن محلول پتاسی پرمنگنات برای ناسایی استفاده کرد چون برم سمی است و باعث سوختگی شدید پوست می شود)
در پایان گزارشکار باید نتیجه ی آزمایش و منابع احتمالی خطا را ذکر کرده و با توجه به مطالب گفته شده در مقدمه و متن روش کار،می توان به سوالات مربوطه پاسخ داد.
زندگینامه ی مندلیف

دیمتری ایوانویچ مندلیف شیمیدان بزرگ روسی در فوریه 1834 در شهر «توبوسك» در سیبری روسیه متولد شد او چهاردهمین فرزند خانواده بود پدرش مدیر مدرسه بود او پدر خود را در کودکی از دست داد. او در مدرسه توپولسک استعداد درخشان خود را در ریاضی و فیزیک نشان داد و عصرها بعد مدرسه در کارگاه شیشه گری به مادرش کمک می کرد مدتی بعد کارگاه شیشه گری آتش گرفت و همه سرمایه شان از دست رفت. دیمیتری برای یافتن شغل بهتر به سن پترزبورگ رفت و در آن جا به تدریس پرداخت در سال 1850 توانست بورس تحصیلی بگیرد و به تحصیل در رشته ریاضی، فیزیک و شیمی بپردازد. او خانواده خود را هم به سن پترزبورگ برد اما متاسفانه مادر و خواهرش به بیماری سل دچار شدند و جان خود را از دست دادند و او تنها شد فقر از یک سو و اندوه از سوی دیگر او را چنان بیمار ساخت که پزشکان تصور کردند او نیز به سل میتلا شده است و به او توصیه نمودند برای معالجه و استراحت به یک محل خوش آب و هوا مسافرت نماید. دیمیتری به جزایر کریمه رفت و مدتی را در آنجا ماند. پس از مدتی او سلامت روحی خود را بازیافت و به سنت پترزبورگ بازگشت...
عنوان آزمایش: خالص سازی مواد به روش استخراج
هدف: استخراج آدیپیک اسید از فاز آبی به فاز آلی(اتر)
تئوری آزمایش:
استخراج روشی است برای جداسازی که در آن جسمی از یک فاز به فاز دیگر منتقل می شود. در بعضی مواقع لازم است برای بازیابی یک ماده آلی از راههایی غیر از تقطیر استفاده شود. یکی از این راهها تماس دادن محلول آبی با یک حلال غیر قابل اختلاط با آب است. اگر حلال مناسب باشد، بیشتر مواد آلی(در اینجا آدیپیک اسید) از لایه آبی به حلال آلی (که با آب امتزاج ناپذیر است) انتقال پیدا میکند.
از نظر کمی پخش یک جسم بین دو حلال غیر قابل امتزاج را بر حسب ضریب پخش K بیان میکنند. به عبارت دیگر ضریب پخش(k) یعنی: نسبت غلظت ماده ی حل شده در حلال اول، به غلظت همان ماده در حلال دوم.
حلالی که برای استخراج انتخاب می شود باید دارای این ویژگیها باشد:
1- با حلالی که دارای ماده مورد نظر است،مخلوط نشود.(سیستم دو فازی تشکیل دهد)
2- K ماده در حلال انتخاب شده بزرگ باشد. (یعنی ماده در حلال دوم بیشتر از حلال اول محلول باشد)
3- حلال نباید ما ماده مورد نظر واکنش دهد.
4- حلال انتخاب شده به آسانی تبخیر شود.
5- حلال نباید ناخالصی ها را استخراج کند.
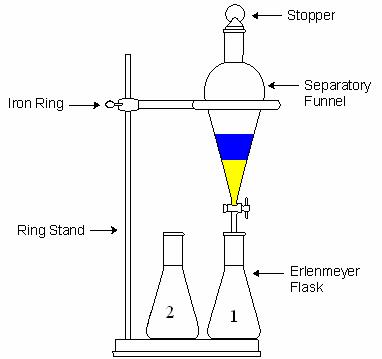
در استخراج مایع-مایع از قیف جدا کننده (دکانتور) استفاده می شود.قیف نباید بیشتر از سه چهارم حجم آن پر شود چون در این صورت امکان هم زدن محلول وجود نخواهد داشت.هدف از تکان دادن و هم زدن این است که سطح تماس دو حلال افزایش یابد و ماده حل شده در حلال اول در مدت زمان کمتری بتواند به حلال دوم برود.(در آن حل شود).هر چند ثانیه یک بار باید قیف را برگرداند(شیر به سمت بالا) و آن را به آرامی باز کرد تا گاز قیف خارج شود.این عمل همیشه باید انجام شود ولی در دو حالت اهمیت بیشتری دارد:
1- وقتی که حلال مورد استفاده دمای جوش پایینی داشته باشد.
2- یک محلول اسیدی با محلولی از سدیم بیکربنات استخراج شود.(در این حالت گاز کربن دی اکسید آزاد می شود)
NaHCO3 + HA = NaA + H2O + CO2
پس از تکان دادن قیف و خارج کردن گازهای آن، قیف جدا کننده را روی گیره ی حلقه ای قرار می دهند و فرصت می دهند تا فازها به خوبی از هم جدا شوند.
انرژی آزاد گیبس را میتوان از این معادلات بدست آورد:
این فرمولها دربرگیرندهٔ دو عامل است که در انجامپذیری واکنشها در طبیعت مؤثرند: آنتالپی (انرژی سیستم) و آنتروپی (بینظمی سیستم).
انتالپی (H) تغییرات انرژی ضمن انجام واکنش را دربرمیگیرد. این تغییرات هم انرژی جنبشی راشامل میشود و هم انرژی پتانسیل را، به شرط آن که در حین انجام واکنش فشار وارد بر سیستم ثابت باشد.
یک واکنش زمانی از نظر انرژی انجامپذیر تلقی میشود که بر اثر انجام آن انرژی سیستم کمتر شود. به عبارت بهتر سیستم پایدارتر شود. در این صورت تغییرات انتالپی منفی خواهد بود.
اما در اطراف ما بسیاری از واکنشها اتفاق میافتند که در آنها سیستم گرما میگیرد و انرژی آن افزایش مییابد، یعنی تغییرات انتالپی در آنها مثبت است. این گونه واکنشها به علت عامل دوم رخ میدهند که آنتروپی نامیده میشود و با S نشان داده میشود. این عامل نشاندهندهٔ میزان بینظمی سیستم است و زمانی مساعد است که انجام واکنش سبب زیادشدن بینظمی در سیستم شود. در فرمول انرژی آزاد گیبس عامل S در T ضرب میشود که دمای مطلق (کلوین) گاز است، یعنی اثر عامل بینظمی در دمای بالا بیشتر است.
وجود نقص موجب افزایش در آنتروپی شبکه میشود و بنابراین همه جامدات تمایل به وجود نقص دارند. G = H - TS
افزایشS ، یک جمله منفی در انرژی آزاد وارد میکند. اگر ایجاد نقص گرماگیر باشد،H مثبت میشود ولی ، بزرگتر از صفر خواهد بود و باز هم انرژی آزاد منفیمیشود. با افزایش دما ، نقصها افزایش مییابد و G منفی تر میشود.
قانون اول ترمودینامیک
قانون اول ترمودینامیک به معرفی انرژی درونی ، U ، منجر شد. این کمیت تابع حالتیاست که بر مبنای آن ، مجاز بودن یک فرآیند مورد قضاوت قرار میگیرد وبیان میدارد که فقط تحولاتی مجاز است که انرژی داخلی کل سیستم منزوی ،ثابت بماند. قانونی که ملاک خودبخودی بودن را مشخص میسازد (قانون دوم ترمودینامیک) ، برحسب تابع حالت دیگری بیان میشود. این تابع حالت ،آنتروپی ، S ، است.
ملاحظه خواهیم کرد که بر مبنای آنتروپی قضاوتمیکنیم که آیا یک حالت بطور خودبخودی از حالت دیگری قابل حصول میباشد.در قانون اول با استفاده از انرژی داخلی ، تحولات مجاز مشخص میشود(آنهایی که انرژی ثابت دارند). از قانون دوم با استفاده از آنتروپی ،تحولات خودبخودی از بین همان فرآیندهایی مشخص میشود که بر مبنای قانوناول مجاز میباشد.
بیان قانون دوم
آنتروپی سیستم منزوی در یک فرآیند خودبخودی افزایش مییابد:
که ، آنتروپی تمام قسمتهای سیستم منزوی میباشد.
ازآنجایی که فرآیندهای برگشت ناپذیر (مانند سرد شدن شیئی تا دمای محیط وانبساط آزاد گازها) خودبخودی است، در نتیجه همه آنها با افزایش آنتروپیتوام میباشند. این نکته را میتوان به این صورت مطرح کرد که در فرایندهایبرگشت ناپذیر آنتروپی تولید میشود. از طرف دیگر ، در فرایند برگشت پذیرتوازن وجود دارد، یعنی سیستم با محیط در هر مرحله در تعادل است. هر مرحلهبسیار کوچک در این مسیر برگشت پذیر بوده و پخش نامنظم انرژی روی نمیدهد ودر نتیجه آنتروپی افزایش نمییابد، یعنی در فرآیند برگشت پذیر آنتروپیایجاد نمیشود. آنتروپی در فرآیندهای برگشت پذیر از بخشی از سیستم منزویبه بخش دیگری منتقل میگردد.
تعریف آماری آنتروپی
بر مبنای تعریفآماری ، فرض میشود که در واقع میتوانیم با استفاده از فرمول ارائه شدهتوسط لوودیگ بولتزمن (Ludwing Boltzmann) در سال 1896 ، آنتروپی را محاسبهکنیم:
که k، ثابت بولتزمن است:
این ثابت به صورت به ثابت گازربط دارد. کمیت W تعداد راههای متفاوتی است که سیستم میتواند با توزیعاتمها یا مولکولها بر روی حالتهای در دسترس به انرژی خاصی برسد. واحدآنتروپی با واحد k یکسان است. در نتیجه واحد آنتروپی مولی ، میباشد؛ (اینبا واحد R و ظرفیت گرمایی یکی است.)
تعریف ترمودینامیکی انرژی
درروش ترمودینامیکی ، تمرکز بر روی تغییر آنتروپی در طول یک فرایند ، dS ،میباشد، نه مقدار معلق S. تعریف dS بر این مبناست که میتوان میزان پخشانرژی را به انرژی مبادله شده به صورت گرما ، در حین انجام فرایند ربطداد. تعاریف آماری و ترمودینامیکی با هم سازگار میباشند. در شیمی فیزیکاین یک لحظه نشاط آور است که بین خواص تودهای (که مورد نظر ترمودینامیکاست) و خواص اتمها یک ارتباط برقرار شود.
تغییر آنتروپی محیط
تغییرآنتروپی محیط را با علامت 'dS نشان میدهیم. علامت پریم مربوط به محیطسیستم واقعی که در سیستم منزوی بزرگ قرار دارد، مربوط میشود. محیط را بایک مخزن حرارتی بزرگ (عملا یک حمام آب) نشان میدهیم که در دمای T باقیمیماند. مقدار گرمای منتقل شده به مخزن در اثر انجام کار مانند سقوط یکوزنه را با 'dq نشان میدهیم که این گرما به مخزن منتقل میشود. هرچهمقدار گرمای بیشتری به مخزن منتقل شود، حرکت حرارتی بیشتری هم در آن ایجادمیشود و از این رو ، پخش انرژی به میزان بیشتری اتفاق میافتد. از ایننکته استنباط میشود که:
اگر گرما به مخزن سردی منتقل شود،کیفیت انرژی نسبت به موردی که آن گرما به مخزن گرمتری داده شود، انحطاطبیشتری خواهد داشت. در مورد اخیر میتوانیم در اثر جاری شدن گرمای 'dq ازیک مخزن سرد به مخزن سردتری کار استخراج کنیم، اما اگر این گرما مستقما بهمخزن سردتر منتقل شود، استخراج چنین کاری امکان پذیر نیست.
نتیجه میگیریم که اگر مقدار معین انرژی به صورت گرما به مخزن گرمی داده شود،آنتروپی کمتری ایجاد میشود تا اینکه آن انرژی به مخزن سردی داده شود.سادهترین راهی که میتوان این وابستگی دمایی را به حساب آورد، چنین است:
که 'T دمایی است که در آن دما ، انتقال گرما صورت گرفته است. برای یک تغییر قابل اندازه گیری در دمای ثابت چنین داریم:
وقتی که مقدار زیادی حرکت حرارتی در دمای پایین ایجاد شود، تغییر آنتروپی بزرگی اتفاق میافتد. برای فرآیند آدیاباتیک:
0 = 'q وقتی 0 = 'S∆
این نتیجه برای هر فرآیندی ، برگشت پذیر یا برگشت ناپذیر ، صحیح است، تا زمانیکه مناطق گرم محلی در محیط ایجاد نشود، یعنی زمانی این نتیجه صحیح است کهمحیط ، تعادل درونی خود را حفظ کند. اگر مناطقی محلی بوجود آید، انرژی ازاین مناطق بطور خودبخودی پخش میشود و در نتیجه آن آنتروپی تولید میشود.موقعی که یک واکنش شیمیایی با تغییر آنتالپی H∆ در سیستمی انجام میشود،گرمایی که در فشار ثابت وارد محیط میشود،
برابر با . بنابراین تغییر آنتروپی محیط برابر است با:
انرژیداخلی V و آنتروپی S ، دو تابع اساسی ، برای توصیف سیستمهای ترمودینامیکیدر حالت تعادلاند، هر سیستم ماکروسکوپیکی که متشکل از انبوه اتم ومولکولهاست، از قانون بقای انرژی تبعیت میکند. حرکت بزرگ مقیاس سیستم ازقانون بقای انرژی مکانیکی تبعیت میکند و در غیاب میدانهای الکترومغناطیسی، انرژی باقی مانده در سیستمی که منزوی است پایسته میماند، این کمیت همانانرژی داخلی است.
قانون دوم
اين برای شما نوشته شده استبرای اينکه قانون دوم ترموديناميک و انتروپی را به سادگی درک کنيد.همه بهجز تعدادی از متون شيمی که به طور کلی نوشته می شوند بيان می کنند کهانتروپی يعنی بی نظمی.به هر حال اگر متن يا آموزگار شما چيزها را به طرزیمتفاوت توصيف می کند بحث نکنيد که درست است يا غلط فقط به خاطر بسپاريد کهشما در متن چه می خوانيد و يا اينکه در کلاس چه می شنويد تا بتوانيد بهامتحان جواب درست بدهيد.امروزه نمرات در زندگی مهم هستند.( اما درک آنچهاين جا فرا می گيريد مدت زندگی را طولانی خواهد کرد.)
قانون دوم ترموديناميک
بسياریاز متون قانون دوم را اين گونه تعريف می کنند:انتروپی جهان در طی يکفرآيند خود به خودی افزايش می يابد؟و سپس qrev/T يا انرژی آزاد =ΔG و ΔSرا به شما می فهمانند.
فهم اين خيلی پيچيده است.هنگامی که سال اول مهندسی شيمی هستيم اين را خيلی ساده فرض می کنيم.
قانوندوم بر مبنای تجربه ی بشری است و از تئوری ها و معادلات پيچيده به دستنيامده است.بنابراين فکر کنيد در مورد تجربه ای که شما داشته ايد:يک سنگخواهد افتاد هنگامی که شما آن را بلند می کنيد و رها می کنيد.ماهی تابه ومواد داخل آن سرد خواهد شد هنگامی که آن را از روی چراغ گاز بر میداريد.آهن در هوا زنگ می زند.هوا در لاستيک های با فشار بالا از يک سوراخکوچک به شدت خارج می شود تا به فشار پايين اتمسفری برسد.تکه های يخ در يکاتاق گرم ذوب می شوند.
در اين فرآيند ها چه اتفاقی می افتد؟بعضی ازانواع انرژی از متمرکز شدن ( متمرکز شدن در سنگ يا ماهی تابه و ...) بهپخش شدن تغيير می يابند.دوباره به مثال ها توجه کنيد تا اين تغيير را درهمه آن ها مشاهده کنيد.
خب اين هم يک راه ساده برای نشان دادن علم نهفته در قانون دوم:
انرژی به طور خود به خودی پخش می شود تا متمرکز نماند البته اگر عاملی آن را به تاخير نياندازد.
اماانتروپی و جهان چطور که در بسياری از متون هستند؟ به طور خلاصه انتروپی رااز نظر می گذرانيم ولی «جهان» فقط به معنی «سيستمی است که شما آن را بههمراه محيط اطرافش می بينيد يعنی هر چيزی که اطراف آن بسته است».سيستمبعلاوه محيط اطراف.اگر «سيستم بعلاوه محيط اطراف» شما را گيج می کند يااينکه شما دوست داريد جزئيات بيشتری در مورد سه فرآيند ذکر شده در بالابدانيد پاراگراف زير را بخوانيد.
۱.سنگ دارای انرژی پتانسيل است هنگامیکه شما آن را از سطح زمين بلند می کنيد.هنگامی که آن را رها می کنيد انرژیپتانسيل به جنبشی تبديل می شود همچنين هنگامی که سقوط می کند مولکول هایهوا را کنار می زند ( بنا براين مقداری از انرزی سنگ پراکنده می شود.)قبلاز اينکه که به زمين برخورد کند به مقدار ناچيزی انرژی صوت ( هوای فشرده )را پراکنده می کند و اندکی باعث گرم شدن خود و زمينی که به آن برخورد میکند می شود.سنگ بدون تغيير است ( پس از يک دقيقه که مقدار ناچيزی از گرمایبرخورد را در هوا پراکنده کرده است).ولی انرژی پتانسيلی که ماهيچه های شماصرف بالا بردن سنگ نمود اکنون در محيط اطراف پخش شده است کمی در حرکتمولکول های هوا و کمی گرم شدن زمين و هوا.{سيستم : سنگ بالای زمين و سپسروی زمين. محيط اطراف : هوا به همراه زمين .}
۲.اتم های آهن در ماهیتابه داغ به سرعت در حال ارتعاش هستند.بنابراين انرژی حرکتی در ماهی تابه داغ متمرکز است.انرژی حرکتی اگر بتواند پخش می شود.هر گاه مولکول های ( باحرکت کند تر )هوای سردتر اتاق به ماهی تابه داغ برخورد می کنند اتم های بهشدت مرتعش آهن مقداری از انرژی خود را به مولکول های هوا منتقل میکنند.بنابراين انرژی متمرکز ماهی تابه پخش می شود و به طور وسيع تر بينمولکول های هوا تقسيم می شود.
{ سيستم : ماهی تابه و محيط اطراف : هوای اتاق .}
۳.آهندر سوزن ها يا چيزهای ديگر نبايد داغ باشد ( يعنی حرکت بسيار شديد مولکولها يا اتم ها) برای اينکه انرژی متمرکز درون آن به صورت شميايی موجود باشد: اتم های آهن وبه همراه مولکول های اکسيژن موجود در هوا شامل يک انرژیشيميايی در ميان پيوندهای شيميايی خود هستند که اين انرژی از انرژی موجوددر زنگ آهن ( اکسيد آهن ) بيشتر است. (اين دليل واکنش اکسيژن با آهناست-آزاد کردن انرژی از سطح انرژی بالاتر موجود در پيوندهای اکسيژن بههمراه پيوندهای آهن و شکل دادن سطح انرژی پايين تر موجود در پيوند هایاکسيد آهن٫ با همه اين اختلاف در انرژی پخش شدن در محيط اطراف به صورتگرما نيز داريم يعنی واکنش گرمازا است و مولکول های محيط را وادار می کندکه سريع تر حرکت کنند.اما فراموش نکنيد که حتی موادی که مقدار زيادی انرژیدر پيوند های خود دارند از اين که اين انرژی را به صورت ناگهانی در محيطپخش کنند جلوگيری می شوند.مقدار زيادی انرژی لازم است برای اين که پيوندهای آن ها شکسته شود قبل يا در حين واکنش.با وجود اين که انرژی خيلیبيشتری ممکن است در نتيجه واکنش و تشکيل پيوند های جديد آزادشود.)بنابراين حتی در هوای مرطوب که سرعت فرآيند افزايش می يابد آهن بهطور خود به خودی ( ولی نه خيلی سريع ) با اکسيژن واکنش می دهد و هر کدامانرژی های موجود در پيوند های خود را در محيط پخش می کنند هنگامی که آهنبا اکسيژن اکسید آهن را تشکيل می دهند.{سيستم : آهن٫اکسيژن و اکسيدآهن.محيط اطراف : هوای نزديک ٫ رطوبت يا نمک به همراه هر چيزی که با زنگآهن در تماس است.}
انتروپی چيست؟
انتروپی پخش شدن خود به خودی انرژیرا نشان می دهد: چه مقدار انرژی در يک فرآيند پخش می شود٫يا با چه وسعتیپخش می شود-در يک دمای خاص.(بعضی وقت ها يک معادله ساده٫تغييراتانتروپی=دما/انرژی پخش شده يا qreversible/T و هنگام تغيير فاز مانند ذوبو تبخير عبارت است از ΔS = ΔHfusion /T or ΔHvaporization /T .)
در شيمی انرژی که انتروپی را بيان می کند عبارت است از «انرژی حرکتي» ٫ انرژی انتقالی٫ارتعاشی و چرخشی مولکول ها
وΔH انرژی تغيير فاز -در بسياری از معادلات هم انرژی حرکتی و هم انرژیتغيير فاز با "q" يا ΔH نشان داده می شوند.«انرژی پيوند» انرژی پتانسيل کهبا پيوند های شيميايی در ارتباط است و ما در مثال اکسيد شدن آهن در موردآن صحبت کرديم٫ فقط به وسيله انرژی پتانسيل تشکيل پيوند ها اندازه گيری میشود.در اين مورد نيز در مثال مذکور اندکی بحث شد.و اين نيز فقط به وسيلهتغيير انتروپی هنگام انجام واکنش با رابطه ΔG = ΔH - T ΔS اندازه گيری میشود.
آيا اين توصيف از تغيير انتروپی پيچيده است؟انتروپی يک نوع مقياس«قبل و بعد» فلسفی و علمی است-اندازه گيری مقدار انرژی منتشر شده تقسيم بردما يا وسعت پخش شدگی انرژی پس از اينکه چيزی اتفاق می افتد ( در يک دمایثابت).هنگامی که اولين رابطه مربوط به انتروپی در يک فرآيند برگشت پذيرديده می شود ابتدا ممکن است گيج کننده و خلاصه به نظر برسد.اجازه دهيد بهآن با استفاده از عبارت «چه مقدار» بنگريم٫يک مثال عملی: يخ در اتاق گرمبه طور خود به خودی ذوب می شود.(تغيير فاز و افزايش انتروپی ).
تغيير فاز -«چه مقدار» انرژی در اين مثال پخش شده است.
ازتجربه خود -به ياد آوريد که اين مبنا و اساس قانون دوم است-شما فکر میکنيد انرژی مولکول ها در چه جهتی حرکت کرده است.از آن مولکول های سريعموجود در هوای اتاق به سمت مولکول های کند يخ يا اينکه مولکول های کند تريخ انرژی خود را به هوای گرم داده اند.مطمئناً هميشه از گرم تر بهسردتر.انرژی حرکتی بيشتر مولکول های هوا مقداری انرژی را در يخ سرد پخشکرده اند و پيوند های هيدروژنی بين مولکول های آب در يخ را شکسته يادگرگون ساخته اند.آب مايع در کوچک ترين دمای بالای نقطه ذوب شکل می گيرد وبالعکس يخ جامد در کوچک ترين دمای زير نقطه ذوب به وجود می آيد.
هنگامیکه مولکول های گرمتر هوا مقداری از انرژی حرکتی خود را منتقل می کنند تادر يخ پخش شود٫ بسياری از پيوند های هيدروژنی در يخ شکسته می شود.اين بهمولکول ها اجازه می دهد که با همان مقدار انرژی که در اثر ارتعاش در يخدارا بودند حرکت کنند اما اکنون پيوند های جديدی با مولکول های ديگر آبمايع شکل گرفته است ٫و در واقع حرکت کمی دارند اما در مقايسه با حالت جامدبسيار زياد است.(سرعت آن ها افزايش نمی يابد٫ و به اين ترتيب مجموع انرژیجنبشی مايع بدون تغيير است و هنگامی که يخ ذوب می شود دما از ۲۷۳ کلوينبالاتر نمی رود.)به هر حال اين فقط يک افزايش در انرژی پتانسيل آب مايع در۲۷۳ کلوين در مقايسه با يخ است٫ ديگر همه مولکول ها در چهارچوب بسيار محکميخ گرفتار نيستند.آن ها هنوز پيوندهای هيدروژنی در آب هستند اما با شکلدادن پيوندهای جديد و شکستن پيوند های ديگر به طور ثابت در مايع حرکت میکنند.
با شکستن آن پيوند های هيدروژنی اوليه و اجازه دادن به مولکول هابرای اينکه آزادانه حرکت کنند چه مقدار انرژی در ذوب يخ پخش می شود؟ البتهبه اندازه آنتالپی ذوب يخ! به اين دليل است که متن شما افزايش انتروپی رادر ذوب يخ ΔS = qrev /T = ΔH/T بيان می کند.
انتروپی استانداردـ «چه مقدار» انرژی يک نمونه پخش شده است.
بسياریاز متون از انتروپی استاندارد (So298) همه عناصر و ترکيبات سخن میگويند.در واقع ٫ انتروپی استاندارد بايد «تغيير انتروپی استاندارد» برایمواد ناميده می شد.اين به اين خاطر است که مقدار So298 که در جداول ليستمی شود در واقع مجموع انرژی(qrev ) است که به طور برگشت پذير پخش شده است( در هر نسبت افزايشی از دما يعنی qrev/T )
استاد : خانم سحر ملکی
نویسنده : کامران مومن زاده
روشهای مختلفی برای جداسازی مواد اجزای سازنده یک محلول وجود دارد که یکی از این روشها فرایند تقطیر میباشد در روش تقطیر جداکردن اجزاء یک مخلوط ، از روی اختلاف نقطه جوش آنها انجام میگیرد. تقطیر در عمل به دو روش زیر انجام میگیرد. روش اول شامل تولید بخار از طریق جوشاندن یک مخلوط مایع ، سپس میعان بخار ، بدون اینکه هیچ مایعی مجددا به محفظه تقطیر بازگردد. در نتیجه هیچ مایع برگشتی وجود ندارد. در روش دوم قسمتی از بخار مایع شده به دستگاه تقطیر باز میگردد و به صورتی که این مایع برگشتی در مجاورت بخاری که به طرف مبرد میرود قرار میگیرد. هر کدام از این روشها میتوانند پیوسته یا ناپیوسته باشند.
دستور كار مقاومت الكتريكي با حرارت
دستور كار پديده هاي الكترومغناطيسي
دستور كار مقاومت الكتريكي با حرارت
دستور كار پديده هاي الكترومغناطيسي
استاد : خانم سحر ملکی
نویسنده :
کامران مومن زاده
عنوان:
سنتز استانیلید
هدف:
سنتز استانیلید از آنیلین و استیک انیدرید.
ابزار و مواد لازم:
پیست آب مقطر-ارلن-استوانه مدرج-پیپت-چراغ بونزن-ترازو-کاغذ صافی-قیف شیشه ای
آنیلین-استیک انیدرید-اسید سولفوریک
تئوری آزمایش:
آنیلین
انواع آنیلین
1) تجاری
2) خالص شیمیایی
کاربرد و مصارف
1) بطور وسیع در ساخت رنگهای نساجی و مواد میانی رنگهای نساجی استفاده می شود.
2) در صنایع لاستیک سازی ، از مشتقات آنیلین به عنوان تسریع کننده و تقویت و استحکام لاستیک و ضد اکسید شدن استفاده می شود.
3) در صنایع داروسازی ، آنیلین در ساخت داروهای سولفانیل آمید و عوامل شیرین کننده سنتتیک مصرف می شود.
4) آنیلین همچنین در صنایع انفجاری از اهمیت خاصی برخوردار است و در ساخت ژلاتین و نیتروتولوئن استفاده می شود.
دانلود گزارشکار آزمایشگاه فیزیک2 بالینک مستقیم و با فرمت ورد(word)


![]() فرمت: word
فرمت: word
![]() دانلود:دانلود فایل
دانلود:دانلود فایل
![]() رمز: oil-yasuj.vcp.ir
رمز: oil-yasuj.vcp.ir
هدف از انجام این آزمایش تهیه نمک مضاعف سولفات آمونیم مس(II) و نمک مضاعف سولفات آمونیم نیکل(II) و کمپلکس تترا آمین مس(II) و مقایسه پاره ای از خواص نمک ساده، نمک مضاعف و نمک کمپلکس و همچنین تهیه زاج های کروم، آلومینیوم و آهن با استفاده از واکنشگر های لازم و بررسی رشد بلوری آن ها می باشد.
در کمپلکس ها پیوند بین فلز و گروه های غیر فلزی دهنده الکترون (لیگاند) از نوع پیوند کئوردیناسیون می باشد. لیگاند ها را بسته به تعداد اتم کئوردینانس شونده، به لیگاند های یک دندانه، دو دندانه و... تقسیم می کنند. لیگاند های کی لیت دهنده می توانند همزمان از بیش از یک موقعیت به فلز متصل شوند. کی لیت ها کمپلکس هایی پایدارند و حلقه های 5 و 6 عضوی آن ها پایدارتر هستند.
Fe(CN)2 + 4 KCN → K2Fe(CN)6
AgCl + 2 NH3 → Ag(NH3)2Cl
پتاسیم هگزا سیانو فرات(II) در آب حل شده و محلولی را می دهد که هیچ نوع واکنش مشخص کننده یون Fe2+ ندارد، زیرا این یون در محیط آزاد نیست و به صورت [Fe(CN)6]4- وجود دارد. این یون یک یون کمپلکس است.
یک دسته معمول از نمک های مضاعف، زاج ها هستند که در حقیقت سولفات مضاعف پتاسیم و آلومینیم هستند.(KAl(SO4)2,12H2O)
فعالیت نوری میزان توانایی یک ماده در چرخش نور قطبیده مسطح میباشد. اگر جسم شفافی بتواند سطح نوسان بردار میدان الکتریکی را به اندازه زاویه (آلفا) بچرخاند، میگویند جسم توانایی چرخش نور را داشته یا از نظر نوری فعال است. این پدیده اولین بار در سال 1811میلادی برای کوارتز گزارش شد و از آن به بعد مطالعات وسیعی در مورد آن انجام شده است. در اواسط قرن نوزدهم میلادی قوانین بنیادی در مورد فعالیت نوری وضع گردید که منجر به پیشرفت اساسی در شیمی فضایی ترکیبات آلی شد. امروزه برخی از همان نظریات مورد قبول است. در فعالیت نوری ، ماده و نور ، با واکنش متقابل سبب چرخش نور قطبیده مسطح میشوند.
محلولهای فعال نوری
محلولهای فعال نوری ، محلولهایی هستند که دارای کربن نامتقارن میباشند، مانند گلوکز ، اسید تارتاریک ، اسید لاکتیک. این محلولها قادرند صفحه پولاریزاسیون را بچرخانند که مقدار زاویه چرخش متناسب با غلظت مایع و طولی از آن میباشد که نور قطبیده از آن میگذرد. همچنین مقدار زاویه به طول موج نور تابشی بستگی دارد که معمولا از خط سدیم (5893 آنگستروم) استفاده میکنند. درجه حرارت و نوع حلال هم تا حدودی در این مقدار موثر هستند.
استاد : محمد حسین لک
نویسنده : کامران مومن زاده
آشنایی با وسایل اندازه گیری
برای اندازه گیری شدت جریان گذرنده از مداراز این دستگاه استفاده می شود که بصورت سری در مدار قرار می گیرد آمپرسنج ایده ال دارای مقاومت صفر است.در هنگام وجود آمپرسنج مقدار جریان جدید به وجود آمده از جریان اولیه کمتر است که دلیل آن وجود مقاومت در دو سر آمپرسنج می باشد.اگر در هنگام بستن مدار جای دو سر سیم اتصالی به آمپرسنج را اشتباهی بزنین عقربه آمپرسنج به سمت منفی می رود.
ولت سنج(ولت متر):
برای اندازه گیری اختلاف پتانسیل بین دو نقطه از این دستگاه استفاده می شود که به صورت موازی در مدار قرار می گیرد.هنگامی که مقاومت به صورت موازی بسته شد مقاومت موجود که در نتیجه وجود ولت متر بوجود می آید کمتر از مقاومت در حالت ابتدایی است. برای مقاومت های بزرگ مقاومت ولت متر تاثیر گذار نخواهد بود.ولت سنج ایده ال دارای مقاومت بی نهایت است.
گانوانومتر:
برای اندازه گیری شدت جریان های خیلی کوچک استفاده می شود.
اهم متر:
وسیله ای است برای اندازه گیری مقاومت بین دو سر سیم .وهرگز با اهم متر مقاومت قطعه ای که از آن جریان می گذرد را اندازه گیری نمی کنیم.
عنوان : گزارش کار تهیه صابون (آزمایش صابونی شدن)
تئوری :
می دانید ساختار یک مولکول صابون به صورت زیر است:
CH3-(CH2)n-COO- +X در صابونهای جامد X یون سدیم و در صابونهای مایع پتاسیم و آمونیوم می باشد.
در تهیه ی صابون ابتدا یون هیدروکسید باز به عنوان نوکلئوفیل (هسته دوست) به کربن گروه کربنیل حمله کرده، پس از خارج شدن یک مولکول الکل، انیون اسید به صورت هیبرید رزونانس فوق، پایدار میگردد.
الکل نقش حلال را دارد. مواد اولیه برای تولید صابون چربی (مولکول آلی و غیر قابل حل در آب) و باز (مانند سود که در آب انحلال پذیر است) می باشند. برای اینکه واکنش بین دو ماده ی اولیه ، یعنی چربی و باز، بهتر صورت گیرد باید از یک حلال استفاده کرد که هر دو ماده ی اولیه را در خود حل نماید. الکل بسیار مفید است زیرا الکل مانند C2H5OH دارای یک سر هیدروکربنی و یک سر قطبی است و می تواند هر دو ماده ی اولیه را در خود حل کرده و درنتیجه واکنش بین ان دو سریعتر و کاملتر انجام گیرد.
استاد:کریمی
عنوان آزمایش :
شناسایی و جداسازی کا تیون های گروه I
مختصری درباره عناصر گروه I ( گروه نقره )
نقره ( Ag )
نقره، يکي از عناصر شيميايي، با نشانه Ag ، داراي عدد اتمي 47 و وزن اتمي 107.8682 است که در گروه يک فرعي (IB ) جدول تناوبي قرارگرفته است . نقره عنصري فلزي به رنگ سفيد مايل به خاکستري و براق مي باشد که تقريباً کمياب و گران قيمت است و از نظر فراواني در قشر جامد زمين ، در مرتبه شصت و سومين عنصر قرار دارد. در آب و هواي خالص پايدار است ولي در معرض اوزون ، سولفيد هيدروژن و هواي داراي سولفور کدر مي شود. نقره ی خالص دارای بالاترين هدايت الکتريکي و گرمایی است و پايين ترين مقاومت را در بين تمام فلزات دارد. در سنگ معدن هاي داراي آرژنتيت ، سرب ، روي و مس و طلا يافت مي شود .
از نظر شيميايي نقره يکي از فلزات سنگين و از جمله فلزات نجيب است و از نظر تجاري عنصري گرانبها تلقي ميگردد. از نقره ، 25 ايزوتوپ راديواکتيو شناخته شده است که داراي اجرام اتمي 102 الي 117 ميباشند. نقره معمولي هم از دو ايزوتوپ با جرم هاي 107 و 109 تشکيل شده است.
نقره از زمان هاي خيلي قديم شناخته شده بود. اين عنصر اولين بار از سرباره هاي آتشفشاني در آسياي صغير و در درياي اژه پيدا شد. اين آثار نشان مي دهد که 3000 سال قبل از ميلاد مسيح انسان ها توانايي اين را داشتند که نقره را از سرب جدا کنند.
همچنین نقره از خالص کردن و پالايش الکتريکي مس به دست مي آيد و براي کاربردهاي تجاري داراي خلوص 99.9 درصد است.
اساسا نقره خالص فلزي براق و نرم و داراي درخشندگي بالا است. سختي آن از طلا پايين تر و داراي مفتول پذيري و چکش خواري بالايي بعد از طلا و پالاديم است. نقره خالص داراي خصوصيت رسانايي بالاي جريان برق و الکتريسيته در بين تمام فلزات است و مقاومت کنتاکت الکتريکي آن پايين مي باشد. چگالی نقره 5/10 برابر آب است و در 961 درجه سانتيگراد ذوب شده و در حدود 2162 درجه سانتيگراد ميجوشد.
هدف آزمايش :
هدف از اين آزمايش تشخيص و شناسايي كاتيون هاي گروه مي باشد . در اين آزمايش علاوه بر اين هدف ، هدف هايي چون آشنايي با تركيبات كاتيون هاي اين گروه ، محلول يا نامحلول بودن اين تركيبات ، برخي واكنش هاي موجود در محلول هاي آبي و تفسير مراحل تجزيه توسط اين واكنش ها را فراگرفتيم .
نتيجه ي آزمايش :
در اين آزمايش كاتيون هاي گروه شناسايي شدند . بدين ترتيب كه كاتيون سرب كه ممكن بود در مرحله ي تجزيه ي كاتيون هاي گروه به دليل غلظت پايين قابل شناسايي نبوده ، توسط رسوبات زرد رنگ سرب كرومات تشخيص داده شد . كاتيون جيوه بهد از كاهش ، توسط رسوب سياه جيوه و سفيد (در مجموع به رنگ خاكستري) شناسايي شد . كاتيون مس نيز توسط رنگ آبي مشخص مايع شوايتزر از طريق تشكيل كمپلكس آمونياكي مس مورد شناسايي واقع شد . كاتيون بيسموت نيز از كاهش هيدروكسيد آن به بيسموت فلزي سياه رنگ شناسايي شد و بلاخره كاتيون كادميوم ، بعد از پوشش اثر يون مس توسط كمپلكس سيانيدي آن ، از طريق رسوب زرد رنگ سولفيد آن شناسايي شد .
به اين ترتيب در نمونه ي شماره ي 17 ، همه ي كاتيون هاي گروهB موجود مي باشد .
ابزار مواد مورد نياز :
5 لوله ي آزمايش – همزن شيشه اي – سانتريفوژ – مجموعه ي حمام بن ماري – كاغذ سنج عمومي – نمونه ي مورد آزمايش (شماره ي 17) – اسيد نيتريك 6 مولار – اسيد كلريدريك 6 مولار – آب مقطر – كرومات پتاسيم 1 مولار – اسيد سولفوريك 3 مولار – آمونياك 15 مولار – اسيد نيتريك 16 مولار .
جلسه چهارم
شناسایی و جداسازی
یون های گروه III
مختصری درباره عناصر گروه III ( گروه نیکل - آلومینیوم )
نیکل
نیکل فلزی سخت ، چکش خوار، براق با ساختار بلورین مکعبی به رنگ سفید- نقره ای است . این عنصر در سال 1751 توسط Axel Cronstedt دانشمند سوئدی کشف گردید .
از نظر خواص مغناطیسی و فعالیت شیمیایی شبیه به آهن وکبالت است . کانی های اصلی نیکل ، پنتلاندیت ، پیروتیت (سولفید های نیکل- آهن) و گارنییریت (سیلیکات نیکل- منیزیم ) هستند.
این عنصر رسانای جریان برق است و سطح آن براق و صیقلی می باشد. این عنصر از گروه عناصر آهن و کبالت می باشد و آلیاژهای آن قیمت های بالایی دارند.
این عنصر کاربردهای فراوانی در طبیعت دارد و برای ساخت فولاد ضد زنگ و دیگر آلیاژهای ضد زنگ و خوردگی مثل اینوار و مانل که آلیاژى از نیکل و کبالت که در برابر خوردگى مقاوم است و و اینکونل و Hastelloys کاربرد دارد. برای ساخت لوله های نیکلی و مسی و همین طور برای نمک زدایی گیاهان و تبدیل آب شور به آب مایع استفاده می شود. نیکل استفاده های فراوانی برای ساخت سکه ها و فولاد نیکلی برای زره ها و کلید ها کار برد دارد و همین طور از نیکل می توان آلیاژهای نیکروم و پرمالوی و آلیاژی از مس را تهیه کرد.
از نیکل برای ساخت شیشه های به رنگ سبز استفاده می شود. صفحات نیکلی می تواند نقش محافظت کننده برای دیگر فلزات را داشته باشد.. همچنین صنعت سرامیک و ساخت آلیاژی از آهن و نیکل که خاصیت مغناطیسی دارد و باتری های قوی ادیسون کاربرد دارد. از ترکیبات مهم نیکل می توان سولفات و آکسید را نام برد.
نیکل هم به صورت فلز و هم به صورت ترکیب محلول می تواند وجود داشته باشد.
عوامل زيادي در کيفيت و کميت رسوب تاثير دارد از جمله :
الف) جنس سطح : جنس سطح هم در کميت و هم در کيفيت آن به ويژه از نظر چسبنده و غير چسبنده بودن موثر است. در يکي از تحقيقات علمي نشان داده شده است که آبي با PH برابر 8.4 و سختي و قلياييت اوليه برابر PPm 205 معادل کربناتي در عرض 100 ساعت بر روي سطح چدني بيش از 60 برابر سطح فولاد ضد زنگ رسوب ايجاد کرده است. اما اين ادعا که برخي مطرح مي کنند که اصلا رسوبي ايجاد نمي شود درست نيست چون آب اشباع از املاح در تماس با هر سطحي در دراز مدت رسوب ايجاد خواهد کرد هر چند که مقدار آن ممکن است خيلي کم باشد. نا همواري سطح باعث مي شود که چسبندگي رسوب بيشتر شود. به طور کلي چسبندگي رسوب به نوع ماده ي رسوب و جنس سطح جامد بستگي دارد.
ب PH و قلياييت آب : با توجه به آنکه اولا در PH هاي مختلف جنس رسوب مي تواند فرق کند و ثانيا حلاليت برخي نمکها به PH بستگي دارد مي توان انتظار داشت که PH نقش کليدي هم در کيفيت و هم در کميت رسوب داشته باشد. قلياييت آب در تشکيل رسوب ممانعت کننده از خوردگي فولاد توسط آب موثر است و باعث کاهش نرخ خوردگي فولاد مي شود. چنين رسوبي همانند يک ممانعت کننده ي طبيعي عمل مي کند .
ج) آناليز آب : کلرايد و سولفات باعث افزايش خوردگي آب مي شوند از اين رو نسبت مجموع غلظت کلرايد و سولفات به غلظت قلياييت به عنوان شاخص خوردگي آب در نظر گرفته مي شود.
د) زمان و سرعت ترسيب : هر چه سرعت ترسيب کندتر باشد رسوب توليد شده غير متخلخلتر و سفت تر خواهد بود. علاوه بر ان گذشت زمان چسبندگي بين سطح و رسوب را افزايش خواهد داد.
ه) تاثير عوامل هيدروديناميکي: حرکت سيال روي کيفيت رسوب اثر مي گذارد در سيستم هايي که اب در گردش است رسوب کربنات ايجاد شده سفت و سخت است ولي در آبهاي ساکن کريستال هاي کربنات کلسيم نرم و غير چسبنده مي شوند به علاوه تلاطم جريان باعث تسريع در ايجاد رسوب مي گردد به طوري که در قسمت مستقيم يک خط لوله ممکن است رسوبي ايجاد نشود ولي در زانوهاي همان خط لوله رسوب گذاري شديد انجام شود.
| طيف سنجي الكترون براي تجزيه شيميايي(ESCA ) : سلا م دوستان پاورپوينت اين مطلب در اين قسمت گذاشته شده، ... [بیشتر] (194.8 کیلوبایت) | ||||
| الكترو شيمي تجزيه اي : سلام خدمت تمام دوستان شيميستم اين كتاب توي ارشد راحت گي ... [بیشتر] (22.07 مگابایت) | ||||
| اطلاعاتي در مورد SPE : تقديم به همه دوستان شيميستم ، اگر بدردتون خورد بدردتون ... [بیشتر] (161.7 کیلوبایت) | ||||
| اسلاید آموزش مبحث هیبریداسیون : هیبریداسیون یکی از مباحث نظریه ی vespr است که آشنایی با ان ... [بیشتر] (1.05 مگابایت) | ||||
| گرافن باریکترین ضد زنگ : این text درباره گرافن است (11.6 کیلوبایت) | ||||
| فزایش استحکام گرافن با تا زدن آن : این text در مورد گرافن است (11.8 کیلوبایت) | ||||
| آموزش محلول سازی : این text در مورد طریقه محلول سازیست (173.9 کیلوبایت) | ||||
| ساخت باطری با گرافن : این text در مورد باطری جدید از گرافن است (12.3 کیلوبایت) | ||||
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 26) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 26: آمینواسیدها، پپ� ... [بیشتر] (2.42 مگابایت) | ||||
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 25) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 25: هترواتمها در ترک ... [بیشتر] (1.82 مگابایت) | ||||
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 24) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 24: کربوهیدراتها) تش ... [بیشتر] (2.22 مگابایت) | ||||
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 23) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 23: ترکیبهای دی کربو ... [بیشتر] (1.66 مگابایت) | ||||
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 22) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 22: شیمی بنزن استخ� ... [بیشتر] (2.34 مگابایت) | ||||
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 21) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 21: : آمینها و مشتقات ... [بیشتر] (2.67 مگابایت) | ||||
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 20) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 20: مشتقات کربو کسیل ... [بیشتر] (2.57 مگابایت) |
| راهنمای شیمی آلی ولهارد جلد سوم (فصل 19) : راهنمای شیمی آلی ولهارد جلد سوم (فصل 19: کربو کسیلیک اسید ... [بیشتر] (2.21 مگابایت) | ||||
| آمونیاک : 17 صحفه (126.5 کیلوبایت) | ||||
| افزایش حجم آب هنگام انجماد : 1 صحفه (16.4 کیلوبایت) | ||||
| آشنایی با علائم هشدار دهنده در آزمایشگاه شیمی : 1 صحفه (371.0 کیلوبایت) | ||||
| Flame Ionization Detector - FID : این مقاله در مورد "دتکتور های FID " هست که در دستگاه های تج ... [بیشتر] (1.12 مگابایت) | ||||
| مول : 1 صحفه (13.7 کیلوبایت) | ||||
| پلیمرها : سلام این کتاب برای افرادی که در صنایع پلیمری مشغول به ف ... [بیشتر] (3.94 مگابایت) | ||||
| Food Lipids Chemistry, Nutrition, and Biotechnolog : 5.7MB زبان اصلی 1016ص (5.70 مگابایت) | ||||
| inorganic chemistry : زبان اصلی (3.42 مگابایت) | ||||
| آمونیاک : آمونیاک محرک خسارت نوری فتوسیستم 2 در حضور باکتری Cyanobacte ... [بیشتر] (126.5 کیلوبایت) | ||||
 |
شیمی سال دوم دبیرستان : کتاب شیمی دوم دبیرستان در سال 1340 (1.40 مگابایت) | |||
| Synthetic Methods Catalysis : (1.58 مگابایت) | ||||
| بررسي روش استخراج با حلال براي تصفيه فسفريك اسيد ص : -;{@ (218.1 کیلوبایت) | ||||
| Inorganic chemistry : -;{@ (4.89 مگابایت) | ||||
| لغت نامه ي شيمي : اين لغت نامه انگليسي به انگليسي است (2.88 مگابایت) |
 2) دانلود خلاصه درس شیمی آلی 1 - شیمی آلی و آزمایشگاه (در قالب PowerPoint)
2) دانلود خلاصه درس شیمی آلی 1 - شیمی آلی و آزمایشگاه (در قالب PowerPoint)
 3) دانلود خلاصه درس شیمی آلی 1 - شیمی آلی و آزمایشگاه (در قالب PowerPoint)
3) دانلود خلاصه درس شیمی آلی 1 - شیمی آلی و آزمایشگاه (در قالب PowerPoint)
 4) دانلود خلاصه درس شیمی آلی 1 - شیمی آلی و آزمایشگاه (در قالب PowerPoint)
4) دانلود خلاصه درس شیمی آلی 1 - شیمی آلی و آزمایشگاه (در قالب PowerPoint)
تعیین pH سود
مقدمه و تئوری :
تیتراسیون
تیتر کردن از روشهای تجزیه حجمی است. در تجزیه حجمی ابتدا جسم را حل کرده و حجم معینی از محلول آن را با محلول دیگری که غلظت آن مشخص است که همان محلول استاندارد نامیده میشود، میسنجند. در تیتراسیون محلول استاندارد بهطور آهسته از یک بورت به محلول حاوی حجم مشخص یا وزن مشخص از ماده حل شده اضافه میشود
افزایش محلول استاندارد ، آنقدر ادامه مییابد تا مقدار آن از نظر اکیوالان برابر مقدار جسم حل شده شود. نقطه اکیوالان نقطه ای است که در آن ، مقدار محلول استاندارد افزوده شده از نظر شیمیایی برابر با مقدار حجم مورد نظر در محلول مجهول است. این نقطه را نقطه پایان عمل از نظر تئوری یا نقطه هم ارزی نیز میگویند.
pH و نحوه اندازه گیری آن:
PH از لغت Hydrogene Power گرفته شده ، به معنی قدرت یونی هیدروژن می باشد و بیان کننده ی میزان اسیدی یا بازی ( قلیایی ) بودن آب است .
PH طبیعی آب آشامیدنی حدود 7.0 می باشد و این در حالی است که بیش تر ماهیان آب شیرین در محدوده PH = 5.5 – 7.5 قادر به زندگی می باشند ، اما خانواده ای از سیچلایدها ( سیچلایدهای آفریقایی ) در PH= 8 قابل به نگهداری هستند .
اما به جز PH ، دانستن میزان آمونیاک ، نیتریت و نیترات در آب ضروری می باشد .
شرایط آب ایده آل :
آمونیاک ( 0 ppm ) ، نیتریت ( 0 ppm ) ، نیترات20 ppm ()، PH = 6 - 8.5 بسته به نوع ماهی ، GH = 5-10 بسته به نوع ماهی
اما اصلاً تنظیم نبودن PH آب چه پیامد هایی دارد ؟
در صورتی که آب از حد مورد نیاز ماهی ، اسیدی تر باشد ، علاوه بر آسیب رسیدن به دستگاه تنفس و چشم های ماهی ها ، امکان مرگ زودرس آنها را فراهم می کند . در ضمن ماهی در محیط های خیلی اسیدی یا قلیایی تولید مثل نمی کند .
نحوه ی اندازه گیری PH آب :
برای محاسبه ( PH ) می توان از بسته ( کیت ) های تنظیم خصوصیات فیزیکو شیمیایی آب استفاده کرد .
1- معرفهای کاغذی :
کاغذ تورنسل : به صورت نوار کاغذی باریکی به فروش می رسد که با فرو بردن این کاغذ در آب ، در صورت قلیایی بودن آب ( PH بیش تر از 7 ) به رنگ آبی در آمده و در صورت اسیدی بودن آن ( PH کمتر از 7 ) به رنگ قرمز در می آید .
2- PH متر دیجیتالی : کار با آن بسیار ساده بوده به طوری که پس از قرار گرفتن در آب ، میزان دقیق PH در صفحه ی نمایشگر به نمایش در می آید.
لوازم مورد نیاز: بورت – بشر – استوانه مدرج – بالن ژوژه
روش کار :
0.4 گرم NaoH وزن می کنیم.
داخل بالن ژوژه مقداری آب مقطر و NaoH که وزن کردیم می ریزیم.
حل می کنیم.
وقتی کاملاً حل شد آن را با آب مقطر به حجم می رسانیم.
3 قطره شناساگر متیل اورانژ به محلول اضافه می کنیم.
بعد محلول مجهول را در بشر و محلول معلوم را در بورت می ریزیم.
حجم اولیه را یادداشت می کنیم.
سپس قطره قطره به محلول مجهول، محلول معلوم را اضافه می کنیم.
تا وقتی که رنگ بی رنگ محلول مجهول،زرد شود.
حال حجم جدید را یادداشت می کنیم.
 گزارشکار آزمایشگاه شیمی صنعتی
گزارشکار آزمایشگاه شیمی صنعتی گزارش کار شیمی عمومی2 شناسایی و جداسازی کاتیون های گروه چهارم
گزارش کار شیمی عمومی2 شناسایی و جداسازی کاتیون های گروه چهارم نام آزمایش : تهیه پتاسیم تري اگزالاتو کرومات (III) تري هيدرات
نام آزمایش : تهیه پتاسیم تري اگزالاتو کرومات (III) تري هيدرات آزمایشگاه بیوشیمی1
آزمایشگاه بیوشیمی1 گزارشکار تعیین درصد خلوص مواد شیمیایی
گزارشکار تعیین درصد خلوص مواد شیمیایی دانلود جزوه شیمی عمومی 1
دانلود جزوه شیمی عمومی 1 اتیلن دی آمین تترا استیک اسید (Ethylenediaminetetraacetic acid) (EDTA)
اتیلن دی آمین تترا استیک اسید (Ethylenediaminetetraacetic acid) (EDTA) گزارشکار آزمایشگاه فیزیولوژی جانوری
گزارشکار آزمایشگاه فیزیولوژی جانوری محلول های بافر یا تامپون
محلول های بافر یا تامپون متیل اورانژ چیست و چگونه تشکیل می شود؟
متیل اورانژ چیست و چگونه تشکیل می شود؟ دانلود رایگان جدول تناوبی کامل عنصر ها با Periodic Table 3.8.1
دانلود رایگان جدول تناوبی کامل عنصر ها با Periodic Table 3.8.1 محلول های بافر یا تامپون
محلول های بافر یا تامپون متیل اورانژ چیست و چگونه تشکیل می شود؟
متیل اورانژ چیست و چگونه تشکیل می شود؟ تهيه معرف شيف (فوشين)
تهيه معرف شيف (فوشين) پنس بوته (انبر بوته) (Crucible Tong)
پنس بوته (انبر بوته) (Crucible Tong) چراغ بونزن (Bunsen burner)
چراغ بونزن (Bunsen burner) طرز تهیه ی محلول هاو معرف های مختلف آزمایشگاه زیست شناسی و کاربرد آن ها
طرز تهیه ی محلول هاو معرف های مختلف آزمایشگاه زیست شناسی و کاربرد آن ها جدول تناوبی عناصر
جدول تناوبی عناصر تيتراسيون اسيد کلريدريک توسط محلول سود(بخش اسيد قوي با باز)
تيتراسيون اسيد کلريدريک توسط محلول سود(بخش اسيد قوي با باز) دانلود خلاصه درس شیمی تجزیه دستگاهی
دانلود خلاصه درس شیمی تجزیه دستگاهی