آموزش آنلاین تقارن
باسلام
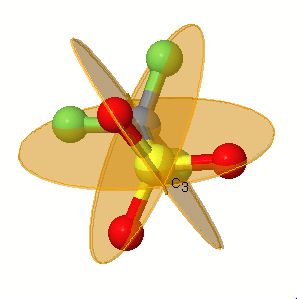
اگر بحث تقارن شیمی معدنی 1 خیلی درگیرتان کرده ، اگر نمی توانید مولکولها یا صفحات و محورهای تقارن آن را تجسم کنید و اگر می خواهید به بهترین شیوه ، محور چرخش مرکب ( محور انعکاس چرخش) و گروه های نقطه ای را یاد بگیرید و به طور جالبی مولکول را در حالی که می چرخد به صورت آنلاین (حتی با اینترنت کم سرعت) مشاهده کنید به وبسایت زیر مراجعه کنید:
http://symmetry.otterbein.edu/gallery/index.html
البته در نظر داشته باشید قبلا باید برنامه جاوا (Java) روی سیستم تان نصب شده باشد اگر این برنامه را ندارید جهت دانلود (به حجم 11 مگابایت ) و نصب به آدرس زیر مراجعه کنید:
http://java.com/en/download/index.jsp
این مطلب در تاریخ: پنج شنبه 7 دی 1391 ساعت: 2:28 منتشر شده است
ثبت تصویر اتم در مولکول
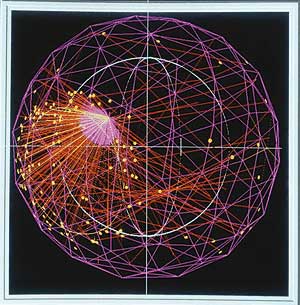
محققان دانشگاه ايالتي اوهايو براي اولين بار موفق به ثبت تصوير حركت اتم در مولكول شدند. اين تصاوير توسط يك دوربين فوقسريع به ثبت رسيده است و ارتعاش 2 اتم درون مولكول را نمايش ميدهد. جالب است بدانيد از انرژي الكترون خود مولكول براي نورانيكردن حركت مولكول استفاده شده است يعني در اين فرآيند انرژي مولكول نقش فلش دوربين را ايفا ميكند. محققان در اين آزمايش از پالسهاي ليزر فوقسريع براي ضربه به الكتروني كه خارج از اربيتال طبيعي خود در مولكول قرار دارد استفاده كردهاند، سپس اين الكترون تحريكشده به سمت مولكول بازميگردد و از سطح آن پراكنده ميشود و عملكردي شبيه به فلش دارد.
منبع: nature
این مطلب در تاریخ: پنج شنبه 7 دی 1391 ساعت: 2:25 منتشر شده است
دانلود کتابچه آموزش نرم افزار Chem office

برای دانلود آخرین ورژن نرم افزار Chem office اینجا کلیک کنید.
این مطلب در تاریخ: پنج شنبه 7 دی 1391 ساعت: 2:21 منتشر شده است
دانلود خلاصه درس شیمی آلی 2
دانلود خلاصه درس شیمی آلی 2
خلاصه شده از روی کتاب شیمی آلی 2 پیام نور

بسیار جامع، کامل،مفید مختصر در 10 صفحه ..
شما هم می توانید خلاصه های خود را برای ما ارسال کنید
تا دوستان خودتون از اون استفاده کنند.
این مطلب در تاریخ: پنج شنبه 7 دی 1391 ساعت: 2:12 منتشر شده است
تولید صنعتی رنگدانه سفید
نگاه کلی
رنگدانهها ، مواد غیرمحلول معدنی و آلی هستند که بطور وسیع در پوششهای سطحی بکار میروند. این مواد در صنایع مرکب سازی ، پلاستیک ، سرامیک ، لاستیک و کاغذ سازی کاربرد دارد. رنگدانهها بسته به رنگ و خواص ، کاربردهای فراوان دارند. رنگدانههای سفید ، یکی از پُر استفادهترین رنگداانهها هستند.پیگمانهای سفید (رنگدانههای سفید)
رنگدانههای سفید بجز تیتان ، از قدیمیترین رنگدانههای پوششی محسوب میشوند که امروزه مصرف تعدادی از آنها تقریبا منسوخ شده است، زیرا نوع جدیدتر و بهتری جانشین آنها شده است که به دیاکسید تیتان معروف است. بجز دیاکسید تیتان که مهمترین رنگدانه سفید است، رنگدانههای سفید سربی هم کم و بیش کاربرد دارند که از جمله آنها میتوان به کربنات ، سولفات ، اکسید روی ، اکسید روی سربدار ، اکسید آنتیموان لیتوپن را نام برد.دیاکسید تیتانیوم
دیاکسید تیتانیوم ، از مهمترین رنگدانههای سفید بوده ، به دو شکل بلوری آناتاز و روتایل پایدار وجود دارد. تقریبا تمامی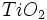 مصرفی در رنگسازی از نوع روتایل است. آناتاز را با حرارت دادن در 700-950 درجه سانتیگراد میتوان به روتایل تبدیل کرد.
مصرفی در رنگسازی از نوع روتایل است. آناتاز را با حرارت دادن در 700-950 درجه سانتیگراد میتوان به روتایل تبدیل کرد. 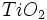 به صورت وسیع در سطوح خارجی و همچنین در لعابها مصرف میشود.
به صورت وسیع در سطوح خارجی و همچنین در لعابها مصرف میشود. | ترکیب رنگ سفید مصرفی درسطوح خارجی | |
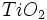 |
20% |
| تالک | 60% |
| میکا | 20% |
این بهترین فرمولاسیون برای جلوگیری از کج شدن و ترک خوردگی است، ضمنا رنگ دوام بیشتری خواهد داشت.
روش تهیه صنعتی رنگدانه سفید تیتانیوم
برای تهیه رنگدانه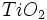 دو روش صنعتی مهم وجود دارد.
دو روش صنعتی مهم وجود دارد.روش سولفات
فرآیند سولفات ، شامل واکنش بین اسید سولفوریک غلیظ و کانی ایلمنیت است. واکنش بسیار شدید است و بجز محصول اصلی مقدار زیادی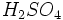 ،
، 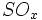 و بخار آب تولید میشود که وقتی وارد جو شوند، موجب آلودگی هوا خواهند شد. بنابراین استفاده از تصفیه کننده در کارخانهها ضروری است. از ضایعات دیگر این روش باز ، تولید اسید سولفوریک مصرف شده بدون برگشت آن به چرخه تولید میباشد.
و بخار آب تولید میشود که وقتی وارد جو شوند، موجب آلودگی هوا خواهند شد. بنابراین استفاده از تصفیه کننده در کارخانهها ضروری است. از ضایعات دیگر این روش باز ، تولید اسید سولفوریک مصرف شده بدون برگشت آن به چرخه تولید میباشد. فرایند اصلاح شده سولفات
در فرایند اصلاح شده با استفاده از اسید سولفوریک رقیق سعی شده است که آلوده کنندهها به حداقل برسند. واکنش نسبتا آهسته صورت میگیرد و مقدار بخار آب و اسید سولفوریک و اسیدهای گوگرد تولید شده کمتر است و اسید مصرفی دوباره به چرخه تولید برمیگردد.واکنشهای انجام گرفته در خط تولید
- واکنش
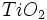 کافی (کانی ایلمنیت) با اسید سولفوریک و تولید این
کافی (کانی ایلمنیت) با اسید سولفوریک و تولید این 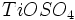
- هیدرولیز
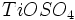 (که بستگی به کیفیت
(که بستگی به کیفیت 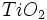 ، غلظت آن و PH محیط دارد) و تولید
، غلظت آن و PH محیط دارد) و تولید 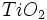 ،
، 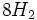
- با حرارت دادن دیاکسید تیتانیوم آبدار در 800_1000 درجه سانتیگراد ، پیگمان سفید دیاکسید تیتانیوم تولید میشود.
- فرایند کلرید ، شامل روتایل (روتایل طبیعی یا سنتزی) و گاز کلرو کک میباشد. محصول به دست آمده در این فرایند ، تتراکلرید تیتانیوم است. برای خالص سازی
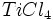 آن را تقطیر کرده و تتراکلرید تیتانیوم خالص را با اکسیژن هوا در شعلهای با دمای 1500 درجه سانتیگراد اکسید میکنند (واکنش سوختن). دراین فرایند دانههای بسیار ریز دیاکسید تیتانیوم و گاز کلر ایجاد میشود. کلر تولید شده دوباره وارد چرخه تولید میشود.
آن را تقطیر کرده و تتراکلرید تیتانیوم خالص را با اکسیژن هوا در شعلهای با دمای 1500 درجه سانتیگراد اکسید میکنند (واکنش سوختن). دراین فرایند دانههای بسیار ریز دیاکسید تیتانیوم و گاز کلر ایجاد میشود. کلر تولید شده دوباره وارد چرخه تولید میشود.
کاربرد
تقریبا 50% این رنگدانه در صنعت رنگ سازی و لعاب سازی مورد استفاده قرار میگیرد. 23% آن در کاغذ سازی مصرف دارد. کاربرد مهم دیگر آن در صنعت پلاستیکسازی است
این مطلب در تاریخ: چهار شنبه 6 دی 1391 ساعت: 13:23 منتشر شده است
هدف از آزمايش:
هدف از اين آزمايش تعيين وابستگي بين طبيعت ماده تيتر (اسيد قوي) و نوع تيتراسيون است. (اسيد ضعيف با باز قوی و باز ضعيف و اسيد قوي)تيتر ميگردد. منحنی تيتراسيون از روي اعداد بدست آمده رسم شده و از روي آن نرماليته و گرم اسيد محاسبه مي شود.
وسايل لازم:
هدايت سنج-پيپت 25 ميلي ليتر- بالن ژوژه 100 ميلي ليتري محتوي نمونه مجهول-بهمزن مغناطيسي- بورت 10 ميلي ليتري- بشر و محلول سود 2/0 مولار
روش کار:
در نمونه مجهول را به حجم رسانده بخوبي مخلوط کنيد، از مجهول را به بشر منتقل کرده به آن حدود آب مقطر اضافه نمائيد. بشر را به هم زن مربوط کنيد سل هدايت سنج را در بشر بگذاريد تا سطح آن کاملاً پوشيده شود دقت نمائيد که الکترود به بهم زن و جداره بشر تماس نداشته باشد، سرعت بهم زن را تدريجاً زياد کنيد. ولي توجه داشته باشيد که سرعت آنقدر زياد نشود که در محلول ايجاد حفره نمايد دستگاه هدايت سنج را روشن کنيد، يک دقيقه صبر کنيد تا گرم شود. قبل از شروع تيتراسيون عدد دستگاه را بخوانيد سپس در فواصل 2/0 ميلي ليتري به 2/0 ميلي ليتر که از ماده تيتراسيون به محلول اضافه مي کنيد اعداد را يادداشت کنيد. نتايج را در کاغذ ميليمتري ببريد بطوريکه مقدار هدايت محلول در محور ها بر عليه ميلي ليتر سود مصرف شده در محور ها رسم شود. نقطه انتهايي نرماليته و غلظت اسيد مجهول را بدست آوريد. شکل منحنی بدست آمده را با ذکر دليل در روي هر شاخه آن توجيه نموده و پيش بيني نمائيد که اگر چنانچه بجاي باز قوي از يک باز ضعيف مانند آمونياک جهت تيتراسيون استفاده مي کرديم چه تغييري در شکل منحني حاصل مي شد؟
(هنگاميکه يک اسيد قوي توسط باز ضعيف تيتر مي شود پس از نقطه اکي والان به دليل اينکه بازي ضعيف است و کم تفکيک مي شود، افزايش هدايت خيلي بکندي صورت مي گيرد، وجود مقدار زيادي نمک در محلول هم باعث کاهش شديد تفکيک باز مي گردد، همچنين به دليل هيدروليز نمک در حدود نقطه اکي والان ، منحني نمايش تغييرات در حدود نقطه اکي والان از حالت متقاطع خارج شود و خميدگي مي يابد.)
این مطلب در تاریخ: پنج شنبه 30 آذر 1391 ساعت: 3:8 منتشر شده است
تيتراسيون اسيد ضعيف(اسيد استيک)با باز قوی
در طي اين آزمايش محلول اسيد استيک با محلول سود تيتر ميگردد، از روي منحنی رسم شده بر حسب هدايت محلول و ميلي ليتر سود اضافه شده نقطه انتهايي تيتراسيون و از آنجا غلظت محلول اسيد استيک را مي توان بدست آورد.
در ابتداي تيتراسيون هدايت محلول به مقدار کمي کم مي شود که مربوط به کم شدن غلظت يون هاي هيدروژن مي باشد سپس هدايت محلول تدريجاً بالا ميرود که اين قسمت مربوط به ازدياد يونهاي استات موجود در محلول است.
در نقطه انتهايي اسيداستيک موجود با سود خنثي مي گردد و سپس بعلت ازدياد يونهاي در محلول هدايت بالا رفته و منحنی با شيب تندتري تغيير مي کند نقطه انتهايي تيتراسيون مي باشد.
روش کار:
نمونه مجهول داده شده را در بالت ژوژه به حجم برسانيد کاملاً آنرا هموژن کنيد، مجهول اسيد استيک را به بشر منتقل کنيد و حدود آب مقطر به آن افزوده و آنرا به هم زن مربوط نمائيد، سلولهاي هدايت سنجي را در آن بگذاريد دستگاه هدايت سنج را روشن کنيد و هدايت محلول را قبل از تيتراسيون بخوانيد، سپس هدايت محلول را با افزودن محلول سود 2/0 نرمال داخل بورت در فواصل 2/0 ميلي ليتري و تا 10 ميلي ليتري در فواصل 2/0 ميلي ليتري، بخوانيد نرماليته و غلظت محلول اسيد استيک را محاسبه نموده و بعد از پايان کار سل هدايت سنج را با آب مقطر شسته در آب مقطر نگه داري کنيد.
این مطلب در تاریخ: پنج شنبه 30 آذر 1391 ساعت: 2:28 منتشر شده است
روش تولید انواع گاز در آزمایشگاه
|
واکنش |
روش |
واکنشگر |
گاز |
|
Ca(OH)2 + 2NH4Cl → NH3+ CaCl2 + 2H2O2 |
به آرامی مخلوطی از آمونیوم کلرید و کلسیم هیدروکسید را حرارت دهید. |
آمونیوم کلراید کلسیم هیدروکسید |
آمونیاک (NH3) |
|
2HCl + CaCO3→ CO2 + CaCl2+ H2O |
اسید هیدروکلریک ۵ مولار را به ۵ -۱۰ گرم پودر سنگ مرمر اضافه کنید. |
کلسیم کربنات ( تراشه مرمر) اسیدهیدروکلریک ۵ مولار |
کربن دی اکسید (CO2) |
|
6HCl + 2KMnO4+ 2H+ → 3Cl2 + 2MnO2 + 2K+ + 4H2O |
با احتیاط قطره قطره اسید هیدروکلریک غلیظ را بر روی مقدار کمی از بلورهای پرمنگنات پتاسیم (در ظرف) اضافه کنید |
پتاسیم پرمنگنات غلیظ هیدرو کلریک اسید |
کلر (Cl2) |
|
2HCl + Zn → H2+ ZnCl2 |
اسید هیدروکلریک ۵ مولار را به ۵- ۱۰ گرم قطعات روی گرانول اضافه کنید. |
روی (گرانول) اسیدهیدروکلریک ۵ مولار |
هیدروژن (H2) |
|
2NaCl + H2SO4→ Na2SO4 + 2HCl |
به آرامی اسید سولفوریک به سدیم کلرید جامد اضافه کنید. |
سدیم کلراید غلیظ اسید سولفوریک |
هیدروژن کلراید (HCl) |
|
CH3COONa + NaOH → CH4 + Na2CO3 |
1 قسمت سدیم استات با ۳ قسمت نوشابه آهک مخلوط کنید. در لوله آزمایش پیرکس خشک یا فلاسک حرارت داد شود. |
سدیم استات (بی آب) سود و آهک |
متان (CH4) |
|
2NH3 + 3CaOCl2→ N2 + 3H2O + 3CaCl2 |
مقدار ۲۰ گرم هیپوکلرایت کلسیم با ۱۰۰ میلی لیتر آب را به مدت چند دقیقه تکان دهید، سپس صاف نموده و ۱۰ میلی لیتر آمونیاک غلیظ به آن اضافه کنید و مخلوط را حرارت دهید. خیلی با احتیاط رفتارشود! کلرامین و و مواد منفجره نیتروژن و تری کلرید تولید می شود. |
آمونیاک کلسیم هیپوکلرایت (پودر سفید کننده) |
نیتروژن (N2) |
|
5O2 + 4P → P4O10 |
بشر بزرگی را بر روی فسفر مشتعل قرار دهید، اکسیژن با فسفر ترکیب شده و پنتا اکسید فسفر تشکیل می دهد که با بخارآب هوا تولید اسید فسفریک می کند که بر جداره بشر می نشیند گاز باقی مانده نیتروژن است. |
هوا فسفر مشتعل (و یا آهن حرارت داده شده یا مس) |
نیتروژن (N2) |
|
Cu + 4HNO3 → 2NO2 + Cu(NO3)2 + 2H2O |
نیتریک اسید غلیظ را به ۵- ۱۰ گرم مس اضافه کنید. |
مس نیتریک اسید ۱۰ مولار |
نیتروژن دی اکسید (NO2) |
|
3Cu + 8HNO3 → 2NO + 3Cu(NO3)2 + 4H2O |
نیتریک اسید ۵ مولار را به ۵ – ۱۰ گرم مس اضافه کنید. |
مس نیتریک اسید ۵ مولار |
نیتروژن منواکسید (NO) |
|
NH4NO3 → N2O + 2H2O |
۱۰ گرم پودر سدیم نیترات و ۹ گرم آمونیوم سولفات را مخلوط کنید. گرمازاست. |
سدیم نیترات آمونیوم سولفات |
نیترواکسید (N2O) |
|
2H2O2 → 2H2O + O2 |
هیدروژن پراکسید را حدود ۵ گرم به دی اکسید منگنز اضافه کنید. |
۶٪ هیدروژن پراکسید دی اکسید منگنز (کاتالیزور) |
اکسیژن (O2) |
|
2KMnO4 → K2MnO4 + MnO2+ O2 |
حرارت دادن پتاسیم پرمنگنات جامد |
پتاسیم پرمنگنات |
اکسیژن (O2) |
|
Na2SO3 + 2HCl → SO2 + H2O + 2NaCl |
هیدروکلریک اسید رقیق را به ۵ – ۱۰ گرم سدیم سولفیت (یا بی سولفیت) اضافه کنید. |
سدیم سولفیت (یا سدیم بی سولفات) ۲مولار هیدروکلریک اسید |
سولفورو دی اکسید (SO2) |
این مطلب در تاریخ: پنج شنبه 23 آذر 1391 ساعت: 1:55 منتشر شده است
تعيين غلظت محلول ها با استفاده از جرم حجمی
|
عنوان: |
تعيين غلظت محلول ها با استفاده از جرم حجمی |
|
نویسنده: |
|
|
ناشر: |
|
|
آدرس سایت: |
|
|
منبع: |
|
|
زبان: |
فارسی |
|
تعداد صفحه: |
5 |
|
نوع فایل: |
|
|
حجم فایل فشرده (KB): |
155 |
|
لینک دانلود فایل |
|
|
توضیح: برای بازکردن فایل pdf به نرم افزار Adobe (acrobat) reader نیاز دارید و در صورتی که فایل باز نشد باید این نرم افزار را تهیه و نصب کنید که این نرم افزار معمولا در سی دی مادر برد کامپیوتر یا سی دی راهنمای برخی محصولات که همراه با خرید به شما داده شده است موجود میباشد. و یا میتوانید از بازار تهیه کنید. ویا از سایت Adobe دانلود نمائید.
|
|
این مطلب در تاریخ: پنج شنبه 23 آذر 1391 ساعت: 1:53 منتشر شده است
گزارش کار شیمی معدنی: تهيه پرمنگنات پتاسيم از سنگ معدن پيرولوزيت و بررسي خواص منگنز و تعيين درجه خلو
|
عنوان: |
گزارش کار شیمی معدنی: تهيه پرمنگنات پتاسيم از سنگ معدن پيرولوزيت و بررسي خواص منگنز و تعيين درجه خلوص آن |
|
گردآوری: |
|
|
ناشر: |
|
|
آدرس سایت: |
|
|
منبع: |
|
|
زبان: |
فارسی |
|
تعداد صفحه: |
13 |
|
نوع فایل: |
|
|
حجم فایل فشرده (KB): |
201 |
|
لینک دانلود فایل |
این مطلب در تاریخ: پنج شنبه 23 آذر 1391 ساعت: 1:51 منتشر شده است
روش تهیه الکل جامد
در دستور العمل زیر از هیدرواکسید سدیم (سود) استفاده می شود که سوز آور است و می تواند کار با آن تا حد زیادی خطرناک باشد. لطفا قبل از شروع آزمایش رفتار شیمیایی این ماده را مطالعه کنید و احتیاط های لازم را انجام دهید و مواظب باشید این ماده در معرض پوست و چشم شما قرار نگیرد.این ترکیب سریعا آتش می گیرد .
احتیاط ها:
همیشه وقتی با سود کار می کنید از دستکش و عینک استفاده کنید.
هیج وقت آب را داخل سود نریزید (باید سود را کم کم وارد آب کرد).
اگر شما از آب و سود استفاده می کنید هرگز از آب گرم یا داغ استفاده نکنید. به طوری که بشود تصور کرد که ۵۰ درصد یخ همراه با آب استفاده شده.
هرگز از قلع، روی یا آلومینیوم همراه با سود سوز آور استفاده نکنید.
سرکه را در دسترس داشته باشید تا اگر آن با پوست شما تماس پیدا کرد از آن استفاده کنید و پوستتان را با آن خیس کنید.
از جوش آمدن سوخت جلوگیری کنید چون که می تواند باعث بروز آتش سوزی و انفجار شود .
ترکیبات (کلیه عناصر بی آب هستند):
۶۷٫۷ قسمت متانول
۲۶ قسمت ایزو پروپانول
۵٫۵ قسمت اسید سیتریک
۰٫۸ قسمت هیدرواکسید سدیم (سود)
دستور العمل:
۱۰ درصد سود / متانول بسازید – ۱۰ گرم سود را در ۹۰ متانول حل کنید.
محلول را تا ۱۰۰ درجه فارنهایت گرم کنید .
اسید سیتریک را به ایزوپروپانول اضافه کنید و تا ۱۴۰ درجه فارنهایت گرم کنید (اسید سیتریک باید ذوب شود) .
مخلوط سود / متانول را به مخلوط اسید سیتریک / الکل اضافه کنید و مخلوط کنید .
سپس آن را داخل قالب بریزید .
روش دوم
ترکیبات:
۱۰۰ قسمت از الکل
۱۰ قسمت استیرن (گلسریل استر سیتریک اسید- یا پیه ) پودر یا نرم شده (از شمع فروشیها می توانید تهیه کنید).
۳ قسمت سود
دستور العمل:
یک حمام آب گرم درست کنید نباید آب جوش بیاد. سپس یک ظرف کوچک مثل قوری را درون آب قرار دهید نباید آب وارد قوری شود
سود را اضافه کنید و هم بزنید
الکل را داخل قوری کوچکتر ریخته و به آرامی استیرن را اضافه کنید و اجازه دهید آن ذوب شود.
حال آن را داخل یه ظرف غیر آلمینیومی بریزید و اجازه دهید سرد شود
روش سوم
جهت ساخت الکل جامد ابتدا یک لیترالکل متانول تهیه نمائید. سپس ۲۰تا۵۰ گرم پودرصابون تهیه نموده وآنرا در۲۵۰سی سی الکل بریزید سپس محلول را در روی چراغ با احتیاط گرم نمائید تا تمام پودر صابون حل شود. درصورت حل نشدن می توانید از ۱۰۰سی سی آب کمک بگیرید. پس از حل شدن صابون محلول را درباقی الکل ریخته وکل محلول را در ظرفی که می خواهید الکل جامد شود ریخته وظرف را در یخچال قرار دهید. پس از چند ساعت الکل جامد شما آماده است و می توانید در قطعات کوچک برش زده واستفاده نمائید.
این مطلب در تاریخ: پنج شنبه 23 آذر 1391 ساعت: 1:48 منتشر شده است








