پیوند های شیمیایی!
بازدید: 4660
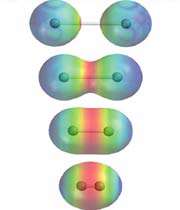
انواع پیوندهای شیمیایی به شرح زیر می باشند:
- پیوند سیگما
- پیوند پای
- پیوند کووالانسی
- پیوند کئوردینانسی
- پیوند فلزی
- پیوند هیدروژنی
در این جا تنها تعدادی از این موارد را توضیح خواهیم داد.
پیوند کووالانسی :
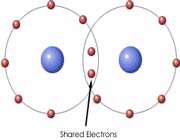
چیزی در حدود 100 عنصر در اطراف ما وجود دارد که ما نمی توانیم آن ها را در حالت خالص شان پیدا کنیم و این مسئله، بیشتر به علت خاصیت واکنش پذیری بالای آن عناصر می باشد. در واقع این عناصر برای تشکیل مواد و اجسام ساده و یا پیچیده با یکدیگر برهم کنش می کنند و در این جا تنها عناصری میل به ترکیب ندارند که آرایش الکترونی اربیتال های آن ها و یا لایه های الکترونی شان پر شده از الکترون است که گازهای نادر یا نجیب یا بی اثر نامیده می شوند.
در واقع چنین ساختاری باعث پایداری هر چه بیشتر عنصر می گردد که به دنبال آن خاصیت واکنش پذیری کمتر می شود. سایر عناصر نیز که دارای چنین ساختاری نیستند، برای رسیدن به آرایش الکترونی کامل و بدست آوردن آن تلاش می کنند.
آن ها در واقع این پیکربندی و یا آرایش الکترونی کامل را از طریق ترکیب شدن با همدیگر یا کسب و یا از دست دادن انرژی، به دست می آورند. بنابراین واکنش پذیری شیمیایی هر عنصر با تعداد و نحوه ی توزیع الکترون ها در اتم های آن عنصر و نیز تغییرات درگیر در واکنش، مرتبط می باشد.
می توان نتیجه گرفت که سطح پایین انرژی یک سیستم ( سامانه )، منجر به پایداری هر چه بیشتر آن سیستم می شود.
اتم ها برای رسیدن به آرایش پایدار الکترونی گاز نجیب که دارای آرایش هشتایی است، از لایه های بیرونی استفاده می کنند. در این جا اتم ها با به اشتراک گذاشتن یک یا تعداد الکترون های بیشتری در دورترین لایه ی الکترونی نسبت به هسته، اقدام به تشکیل پیوند می کنند. این پیوند که از اشتراک الکترونی متقابل حاصل می گردد، پیوند کووالانسی نامیده می شود.
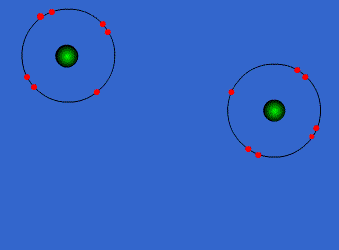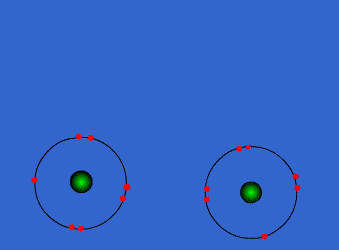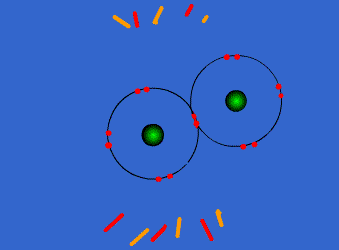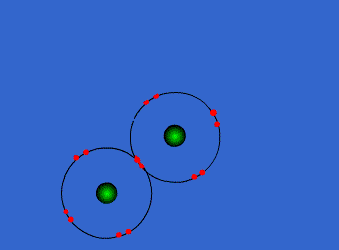
با تشکیل این پیوند، هر کدام از اتم های درگیر در ساخت پیوند، به پایداری می رسند. ترکیباتی که از طریق پیوندهای کووالانسی تشکیل شده اند، ترکیبات کووالانسی نام دارند.
پیوند یونی:
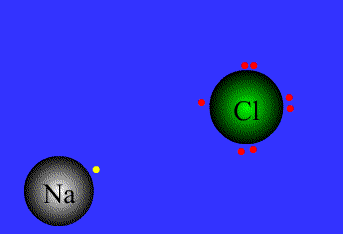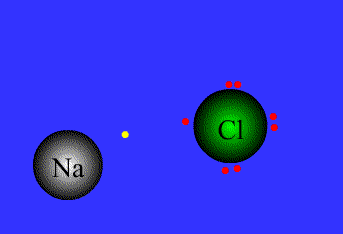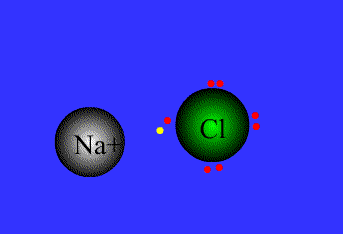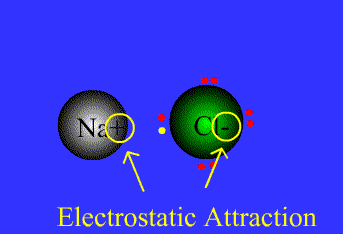
پیوند کئوردینانسی:
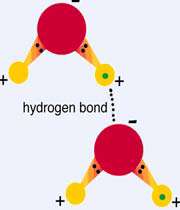
در این جا هیدروژن با عناصر الکترونگاتیوی نظیر فلوئور، اکسیژن و نیتروژن ترکیب می شود ( مانند مولکول آب H2O ،آمونیاک NH3 ). بنابراین ابر الکترونی بین اتم های درگیر در پیوند، بیشتر به سمت اتم های الکترونگاتیو که قدرت جذب الکترون را دارند، تمایل پیدا می کند.
پیوند فلزی:
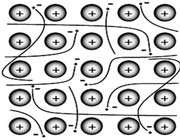
فلزات معمولاً به دلیل انرژی یونیزاسیون پایین می توانند الکترون ها را در خارجی ترین لایه ی خود، به راحتی از دست دهند. آرایش عناصر فلزی بدین صورت است که شبکه ی آن متشکل از اتم خنثی و اتم یونیزه ( اتم هایی که تعدادی از الکترون های ظرفیتی خود را از دست داده اند ) می باشد.
انتقال الکترون از اتم خنثی به اتم یونیزه به راحتی صورت می گیرد. بنابراین در این جا دائماً مبادله ی الکترون انجام می شود و همیشه تعدادی الکترون آزاد در شبکه وجود داشته و این الکترون ها در لحظه مشخصی به اتم به خصوصی تعلق ندارند.
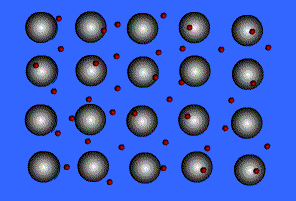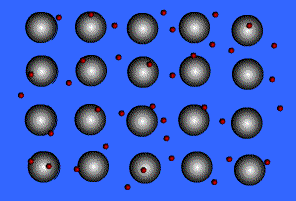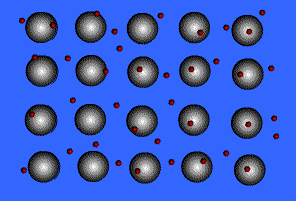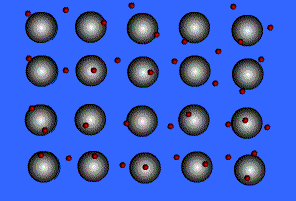
بنابراین می توان شبکه فلزی را یک کریستال سه بعدی متشکل از اتم های خنثی و یون های مثبت دانست که در اتمسفری از گاز الکترون یا دریایی از الکترون های غیر مستقر ، قرار گرفته اند.
جهت یادگیری بیشتر آزمایش زیر را انجام دهید.

چیزی در حدود 100 عنصر در اطراف ما وجود دارد که ما نمی توانیم آن ها را در حالت خالص شان پیدا کنیم و این مسئله، بیشتر به علت خاصیت واکنش پذیری بالای آن عناصر می باشد. در واقع این عناصر برای تشکیل مواد و اجسام ساده و یا پیچیده با یکدیگر برهم کنش می کنند و در این جا تنها عناصری میل به ترکیب ندارند که آرایش الکترونی اربیتال های آن ها و یا لایه های الکترونی شان پر شده از الکترون است که گازهای نادر یا نجیب یا بی اثر نامیده می شوند.
در واقع چنین ساختاری باعث پایداری هر چه بیشتر عنصر می گردد که به دنبال آن خاصیت واکنش پذیری کمتر می شود. سایر عناصر نیز که دارای چنین ساختاری نیستند، برای رسیدن به آرایش الکترونی کامل و بدست آوردن آن تلاش می کنند.
آن ها در واقع این پیکربندی و یا آرایش الکترونی کامل را از طریق ترکیب شدن با همدیگر یا کسب و یا از دست دادن انرژی، به دست می آورند. بنابراین واکنش پذیری شیمیایی هر عنصر با تعداد و نحوه ی توزیع الکترون ها در اتم های آن عنصر و نیز تغییرات درگیر در واکنش، مرتبط می باشد.
می توان نتیجه گرفت که سطح پایین انرژی یک سیستم ( سامانه )، منجر به پایداری هر چه بیشتر آن سیستم می شود.
اتم ها برای رسیدن به آرایش پایدار الکترونی گاز نجیب که دارای آرایش هشتایی است، از لایه های بیرونی استفاده می کنند. در این جا اتم ها با به اشتراک گذاشتن یک یا تعداد الکترون های بیشتری در دورترین لایه ی الکترونی نسبت به هسته، اقدام به تشکیل پیوند می کنند. این پیوند که از اشتراک الکترونی متقابل حاصل می گردد، پیوند کووالانسی نامیده می شود.

پیوند کووالانسی به صورت نیروی جاذبه ی ناشی از اشتراک الکترونی متقابل بین دو اتم، تعریف می شود. اتم های ترکیبی ممکن است یک، دو و یا سه جفت الکترون به اشتراک بگذارند.
با تشکیل این پیوند، هر کدام از اتم های درگیر در ساخت پیوند، به پایداری می رسند. ترکیباتی که از طریق پیوندهای کووالانسی تشکیل شده اند، ترکیبات کووالانسی نام دارند.
نیروی جاذبه ی الکتروستاتیکی قوی که برای اتصال و نگه داشتن دوبار ناهمنام که معمولاً کاتیون و آنیون هستند به کار گرفته می شود، به عنوان پیوند یونی تعریف می گردد.
پیوند های یونی
برای پایه ی انتقال الکترون می باشند.
نوع دیگری از پیوند کووالانسی است که در آن هر دو الکترون از طرف یک اتم برای تشکیل پیوند، به اشتراک گذاشته می شوند.
پیوند هیدروژنی:
در این جا هیدروژن با عناصر الکترونگاتیوی نظیر فلوئور، اکسیژن و نیتروژن ترکیب می شود ( مانند مولکول آب H2O ،آمونیاک NH3 ). بنابراین ابر الکترونی بین اتم های درگیر در پیوند، بیشتر به سمت اتم های الکترونگاتیو که قدرت جذب الکترون را دارند، تمایل پیدا می کند.

فلزات معمولاً به دلیل انرژی یونیزاسیون پایین می توانند الکترون ها را در خارجی ترین لایه ی خود، به راحتی از دست دهند. آرایش عناصر فلزی بدین صورت است که شبکه ی آن متشکل از اتم خنثی و اتم یونیزه ( اتم هایی که تعدادی از الکترون های ظرفیتی خود را از دست داده اند ) می باشد.
انتقال الکترون از اتم خنثی به اتم یونیزه به راحتی صورت می گیرد. بنابراین در این جا دائماً مبادله ی الکترون انجام می شود و همیشه تعدادی الکترون آزاد در شبکه وجود داشته و این الکترون ها در لحظه مشخصی به اتم به خصوصی تعلق ندارند.

بنابراین می توان شبکه فلزی را یک کریستال سه بعدی متشکل از اتم های خنثی و یون های مثبت دانست که در اتمسفری از گاز الکترون یا دریایی از الکترون های غیر مستقر ، قرار گرفته اند.
جهت یادگیری بیشتر آزمایش زیر را انجام دهید.
این مطلب در تاریخ: جمعه 25 اسفند 1391 ساعت: 3:44 منتشر شده است





